Błogosławieństwa i przekleństwa pasywacji
O pasywacji można pisać bardzo wiele, ale ograniczymy się do niezbędnego minimum, by nie zanudzić czytelnika. Po raz kolejny proszę, by pracować z tekstem celem dobrego zrozumienia jego istoty. Uczymy się, że niektóre aktywne metale nie roztwarzają się w kwasach utleniających, bo się pasywują, stają pasywne itp. Czy na pewno? Za chwilę się okaże.
Jak wiemy, kiedy alchemia stawała się dziedziną nauki, stawała się chemią – usystematyzowano wiele pojęć i poszerzający się stan wiedzy. Odkrywano coraz to różniejsze pierwiastki, określano ich właściwości. Część z nich była znana od starożytności, inne są odkryciem czasów nowożytnych. I choć wydaje się to dziwne, to pierwiastki których pełno wokół nas musiały długo czekać na swoje zaistnienie w szeregu pierwiastków. I tak najpospolitszy jest tlen, którego choć pełno w powietrzu, to został odkryty dopiero w roku 1772 i niezależnie w 1774 przez 2 chemików: Scheele i Priestey’a, aczkolwiek eksperymenty z tlenem i powietrzem prowadzono znacznie wcześniej, lecz niestety nie do końca jednak je wtedy rozumiano. Dlatego też oficjalnie odkrycie ogłoszono znacznie później, bo całe kilka wieków od pierwszych eksperymentów. I tak, choć wiele substancji znano od starożytności, to jednak poznanie ich składu nieraz pozostawało zagadką całe setki lat, a gdy to w końcu udało się to ustalić, okazywało się nieraz, że natrafiono na zupełnie nieznany jeszcze metal lub niemetal. I tak jak jak odkryto tlen, tak dopiero w roku 1825 lub 1827 niezależnie od siebie otrzymano glin. Pierwiastek ten był na tyle trudny do otrzymania do tego stopnia, że był droższy niż złoto i zaczęto z niego wyrabiać biżuterię. Ci którzy czytają ten tekst mając w ręce puszkę piwa – zaiste aluminiową – mogą się czuć nieco zdziwieni, bo dziś to jeden z tańszych metali. Co prawda nie najtańszy, ale do cen metali szlachetnych mu bardzo daleko… A jak to się stało, że taki aluminiowy ideał wręcz sięgnął bruku? Jedna odpowiedź wydaje się bardzo oczywista: powszechność tego pierwiastka w przyrodzie, a druga to opanowanie z czasem jego otrzymywania metodami na wielką skalę. Po krótkim pobycie w gronie złota i srebra, cena aluminium spadała niemal z dnia na dzień, najboleśniej zapewne odczuwali to ci, którzy ulokowali w tym metalu swoje oszczędności.
Zadajmy sobie teraz pytanie: dlaczego tak trudno było wyodrębnić glin jako wolny metal? Bo jest to metal aktywny, a takie trudno zredukować do postaci wolnej. Dlaczego więc mimo aktywności jest trwały na powietrzu? Bo na powietrzu pokrywa się się cienką warstewką tlenku i wodorotlenku glinu, która do niego szczelnie przylega i zabezpiecza przed dalszym utlenianiem. To właśnie nazywamy pasywacją. Utworzenie szczelnej warstewki tlenku, zapewniającą barierę dla dalszej reakcji.
W życiu codziennym spotkamy kilka powszechnych metali i stopów. Każdy z nich jest pokryty na powietrzu warstewką tlenku, ale ta warstewka nie musi być szczelna i nie musi gwarantować ochrony. Odsłonięte powierzchniowe atomy metali szybko tworzą pod wpływem powietrza wiązania M=O, M-OH a nawet M-O-M (gdzie M oznacza metal). Dalej takie utleniony atomy mogą się organizować w maleńkie kryształy na powierzchni. Jeśli ta warstewka zorganizuje się w szczelną barierę – reakcja dalej nie biegnie i znajdujące się pod nią warstwy metalu są chronione, bo po prostu reagenty nie mają kontaktu ze sobą. Warstewka nie musi być dla nas widzialna gołym okiem no i zazwyczaj nie jest – jest po prostu bardzo cienka. A jednak nasze aluminium, które potrafi ładnie błyszczeć na świetle (a choćby folia aluminiowa), także jest pasywne. A takie szerzej stosowane żelazo w postaci stali czy żeliwa? Niestety, rdzewieje. Ale jak pokażę potem, i żelazo może być pasywne.
Wiemy już, że glin jest na powietrzu spasywowany, oraz że jest metalem bardzo aktywnym. Zadajmy sobie pytanie, co by było, gdyby nie pasywacja? Wszelakie przedmioty z glinu byłby wybitnie nietrwałe i znikałyby w oczach, ponadto glin łatwo by było zapalić na powietrzu. Wrzucony do wody wydzielałby wodór. Co prawda nie tak intensywnie jak, jak sód w wodzie, ale wydzielanie pęcherzyków byłoby wyraźne. Sproszkowany glin mógłby sam się zapalać na powietrzu. Glin musiałby być przechowany w odpowiednich warunkach – suchym i chłodnym miejscu, jak nieraz czytamy na produktach spożywczych. A zaiste najbezpieczniej byłoby go trzymać w nafcie, jak sód czy potas. I taki to jest paradoks tego metalu – trudno było go otrzymać, bo jest reaktywny, a wydzielony w stanie wolnym potrafi być bardzo trwały.
Czy można się jakoś przekonać o istnieniu tej warstewki pasywnej? W sumie trwałość aluminium na powietrzu powinna być odpowiedzią, dzięki czemu chłodne piwko można pić z puszki aluminiowej. Gdybyśmy do roztworu siarczanu miedzi wrzucili kawałek aluminium, to właściwie nic się nie dzieje, mimo tego, że aluminium leży w grupie metali znacznie aktywniejszych od miedzi. Zalewając aluminium kwasem siarkowym także niewiele zauważymy. Są jednak czynniki, które mogą uszkodzić tę warstewkę. Ot, w wysokiej temperaturze wskutek różnych współczynników rozszerzalności cieplnej warstewka może pękać i odpadać, dlatego też aluminium może się bardzo intensywnie palić podczas pożaru! Nie można go gasić wodą, bo z wodą też intensywnie reaguje tworząc wybuchowy wodór. Pożary tego typu są bardzo kłopotliwe.
Ale czy to tylko kwestia wysokiej temperatury? Pewno nie… O tym, że glin nie wypiera miedzi z roztworu siarczanu miedzi pisałem już wcześniej, wiec trochę się powtórzę. Reakcja z kwasem siarkowym ani z siarczanem miedzi nie zachodzi (a przynajmniej zachodzi bardzo powoli). Gdyby jednak użyć kwasu solnego lub chlorku miedzi – reakcja zachodzi wręcz piorunem, pył aluminiowy zalany stężonym kwasem solnym może wylądować na suficie, folia aluminiowa wrzucona do chlorku miedzi wręcz jest pożerana przez roztwór, który przy okazji staje się gorący. Czy wpływ na to miał anion chlorkowy? Jeśli do roztworu siarczanu miedzi z wrzuconym kawałkiem aluminium wsypiemy trochę chlorku sodu, to zauważymy oznaki reakcji: wytrąca się miedź, a aluminium się roztwarza. Czy NaCl jest katalizatorem tej reakcji? Nie. A przynajmniej nie tak jak działa klasycznie rozumiany katalizator, jeśli mówimy, że jest to katalizator, to tylko pod pewnym względem możnaby, ale powtarzam możnaby, naciagnąć rolę NaCl do roli katalizatora. Dzieje się tak dlatego, że warstewka hydrargilitu, czyli Al(OH)3 (zapisywanego też w postaci tlenkowej jako Al2O3*3H2O) zawiera nanopory, są one na tyle małe, że jony siarczanowe mają trudności się w nich poruszać, za to znacznie mniejsze aniony chlorkowe radzą sobie znakomicie. Drugą ważną kwestią jest fakt, że aniony chlorkowe tworzą połączenia koordynacyjne z glinem. Może zwróciliście uwagę na fakt, że wzór chlorku glinu to w rzeczywistości nie AlCl3, ale Al2Cl6. Dlatego ta sól występuje w postaci dimeru? Dzieje się tak dlatego, że poprzez aniony chlorkowe wytwarza się wewnętrzny kompleks:
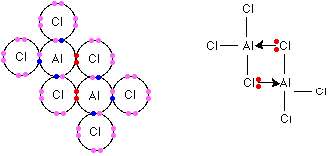
Ale aniony chlorkowe i kompleksy to nie tylko chlorek glinu. Aniony te są w stanie kompleksować też jony glinu z warstwy pasywnej – penetrują, kompleksują, zmieniają, rozszczelniają warstwę pasywną, co skutkuje tym, że glin pokazuje swoje prawdziwe oblicze: metalu bardzo aktywnego.
Zakładam, że części czytelników jest znane pojęcie ochrony protektorowej przed korozją. Polega ona na tym, że metal chroniony przed korozją jest połączony z metalem aktywniejszym od niego i ten metal aktywniejszy ulega korozji zamiast mniej aktywnego. Zastanówmy się teraz, czy aluminium byłoby dobry protektorem. Aby protektor był skuteczny, musi istnieć pomiędzy nim a metalem chronionym odpowiednie połączenie elektryczne, czyli najlepiej metal-metal. Czy jednak istnienie warstwy pasywnej zapewnia dobry kontakt elektryczny aluminium z innym metalem lub stopem (zazwyczaj stalą)? Niestety nie, przez swe ścisłe pokrycie warstwa ta utrudnia kontakt metalom na tyle skutecznie (jest dielektrykiem), że stosowanie protektorów aluminiowych nie ma sensu, ani nie mają sensu farby antykorozyjne zawierające pył aluminiowy, które działałyby na podobnej zasadzie jak istniejące farby ze sproszkowanym cynkiem. Protektory i farby takie oparte na aluminium są skuteczne w walce z korozją… Nad morzem! A dlaczego akurat tam? Myślę, że część już wpadła na odpowiedź: ze względu na silne zasolenie powietrza i gleb w pasie nadmorskim. Akurat Bałtyk nie jest dobrym przykładem, bo jego zasolenie jest wręcz mizerne w porównaniu ze średnim zasoleniem wody morskiej. A na północnych krańcach tego morza woda jest prawie słodka. Ale o tym że sól jest wszędzie możemy mieć okazję się przekonać nad wieloma innymi morzami. Stosowanie protektorów aluminiowych nad morzem ma sens. Tak więc w ochronie protektorowej pasywacja może być poważną przeszkodą, więc tutaj pasywacja aluminium błogosławieństwem nie jest.
Innymi metalami pasywującymi się na powietrzu są chrom i tytan. Wszystkim zapewne są znane powłoki chromowe: pięknie błyszczące elementy chromowane motocykli itp. Dobrze wykonane powłoki chromowe nie tracą błysku ze względu na pasywację i praktycznie brak korozji. Chrom jest też najtwardszym metalem i mniej aktywnym niż żelazo. Tak więc twardość, pasywacja, zdecydowanie mniejsza aktywność tego metalu niż żelazo i potężna różnica aktywności jeśli porównać go do glinu (oczywiście gdyby nie sam nie był spasywowany) czyni powłoki chromowe tak trwałymi. Ale coś za coś. Pokrywając galwanicznie jeden metal innym metalem katodą jest element wykonany z metalu pokrywanego, a anoda z metalu, którym chcemy pokryć ten element. Np. w przypadku srebrzenia będzie to anoda srebrna. Niestety, chrom nie nadaje się na anodę, bo pozostaje pasywny w kąpielach galwanicznych, lub natychmiast się pasywuje. Z tego też powodu kąpiele do chromowania zawierają związki chromu(VI), np. CrO3. Te związki niestety są toksyczne i rakotwórcze, czyli pasywacja jest błogosławieństwem jak i przekleństwem chromowania. Chrom ma jeszcze jedną cenną właściwość: przenosi odporność na korozję (pasywację) na stopy go zawierające. Stal nierdzewna zawiera właśnie dodatek chromu. Niestety, ale glin nie może się tym samym pochwalić, a wręcz przeciwnie, ponieważ jego stopy nie pasywują tak jak wolny metal, to są bardzo wrażliwe na korozję. Z kolei tytan odznacza się dużą odpornością chemiczną – także przez wzgląd na pasywację tego metalu. Jest całkowicie odporny na zasadowe środowisko i dość odporny na rozcieńczone kwasy. Pokrywanie tym metalem świetnie zabezpiecza przed korozją, a powstający na jego powierzchni tlenek i wodorotlenek tytanu to jeden z najbardziej (o ile nie najbardziej) topornych tlenków – metaliczny tytan otrzymano dopiero ok. 100 lat temu, właśnie przez problem z przerobieniem TiO2 na cokolwiek innego. Wśród soli tytanu warto wspomnieć o siarczanie tytanylu TiOSO4M/sub>. Związek ten ulega w wodzie szybkiej hydrolizie zgodnie z równaniem:
TiOSO4 + H2O → TiO2 + H2SO4
Powstający TiO2 może zacząć się osadzać na przedmiotach metalowych, np. na stalowych, tworząc na nich… pasywną warstwę. Oczywiście warstewka ta skuteczna jest, póki nie zostanie uszkodzona mechanicznie, gdyż jest osadzona na innym metalu niż tytan, nie może zatem się odtworzyć po uszkodzeniu, gdyż żelazo pasywuje tylko w kreślonych warunkach. Wracając jednakże do siarczanu tytanylu – farby z dodatkiem tego związku (jako funkcyjnego pigmentu) mają zdolność do zabezpieczania metalu przed korozją w razie jej zarysowania: rysa na farbie odsłania goły metal, ale także ziarna pigmentu twkaiące w powłoce. Pod wpływem wilgotnosci ulegają one hydrolizie i powstajacy TiO2 osadza sie na stali i zabezpiecza ją przed korozją. Byłbym zapomniał, że tytan jest metalem o aktywności zbliżonej do glinu w szeregu elektrochemicznym. I proszę. Da się? Da się, po raz kolejny…
Począwszy od glinu da się spasywować każdy metal – w odpowiednich warunkach. I tak jak już powiedziałem, żelazo da się pokryć warstewką TiO2. Można też odpowiednio utlenić stal na powierzchni (tzw. czernienie, czyli oksydowanie stali) w kąpielach utleniających. Warstewka ta działa, ale tylko do momentu jej uszkodzenia mechanicznego. Żelazo pasywuje też w stężonym kwasie azotowym, co powinniśmy wiedzieć ze szkoły. Zamiast pasywowania można zrobić jego namiastkę za pomocą fosforanów – kwas fosforowy z dodatkiem tlenku cynku (czyli z powstałym z niego fosforanem cynku) tworzy na powierzchni stali trudno rozpuszczalne mieszane fosforany, które także stanowią barierę – ale tylko do czasu uszkodzenia, lub jej rozpuszczenia.
Kilka razy spotkałem z zapytaniem o jakieś efektowne doświadczenie z pasywacją. I tutaj pytanie do czytelnika: czy można wykonać takie doświadczenie? Myslę, że część się domyśla, że niezbyt, bo chyba każdy wie, że wrzucając kawałek aluminium do wody to nic się nie dzieje. I mamy prawdziwy efekt pasywacji – brak reakcji. Nikt chyba z tego powodu nie będzie bił braw, chociaż w sumie należałoby, bo tylko dzięki niej mamy aluminiową puszkę z piwem. Nie spodziewam się zachwytu też jeśli wrzucimy gwóźdź stalowy do stężonego kwasu azotowego, skoro zamiast buzowania zaobserwujemy co najwyżej lekkie zżółknięcie kwasu. Można się co najwyżej przekonać o tym co się dzieje, gdy metal zostaje pozbawiony tej warstewki.
No dobra, zobaczmy jak to wygląda z CuCl2:
[youtube http://www.youtube.com/watch?v=aipdfwaT4kc&w=420&h=315]
Jeśli wrzucimy glin do rozcieńczonego kwasu siarkowego – nic sie nie dzieje. Do siarczanu miedzi – też nic. Ale w obecności chlorków (HCl, CuCl2, NaCl) reakcja zachodzi gwałtownie. Natknąłem się na zadanie maturalne, gdzie glin wypierał miedź z r-ru siarczanu miedzi. Jednak wiemy już, ze to nie jest takie oczywiste. Natomiast reakcja akwymiany wypierania srebra z roztworu azotanu srebra zachodzi, ale powoli. Jony NO3– są wszaksze mniejsze niż SO42-, dzięki czemu penetracja i reakcja zachodzi powoli, ale zachodzi, co możemy zobaczyć na fotce:

Czy metale są pasywne czy się pasywują? Jedne są, inne sie pasywują. Podział jest poniekąd umowny, aluminium i chrom są pasywne na powietrzu, ale nieodporne na kwas solny, podczas gdy np. żelazo jest pasywne w st. HNO3, ale na powietrzu rdzewieje. Wszystko zalezy od tego w jakim środowisku metal się znajdzie, gdyż każdy zdolny do niej metal ma swoje indywidualne warunki do stania isę pasywnym. Z naszego punktu widzenia pasywne jest aluminium, ale nie żelazo, bo ono na powietrzu nie jest pasywne, ale ulega pasywacji w kwasie azotowym. A takie aluminium – było i jest pasywne i przed i po wrzuceniu do st. kwasu azotowego. W sumie jest pewna ciekawa rzecz, która wyróżnia metale spasywowane. Na tlenku i wodorotlenku glinu chętnie osiadają barwniki, podobnie jak na węglu aktywnym. Można w odpowiednich warunkach sterować stopniem pasywności glinu – czyli także wielkością porów w tej warstewce. Jeśli są odpowiednio duże, cząsteczki barwnika mogą wniknąć i zostać zaadsorbowane we wnętrzu porów. Wystarczy wtedy doszczelnić warstewkę pasywną i oto jaki jest efekt barwienia aluminium w wykonaniu mojego kolegi ze studiów (zdjęcia oryginalne 😉 ). To tyle po krótce o pasywacji, zapraszam do obejrzenia fotek radosnej twórczości kolegi 😉
PS a jeszcze muszę wspomnieć o pewnym starym sposobie czyszczenia srebra. Przedmiot srebrny po usunięciu z niego tłuszczu kładziemy na foli aluminiowej lub aluminiowej blaszcze i zalewamy ciepłą wodą z dodatkiem soli i najlepiej dodatkowo jeszcze sody. Cały przedmiot musi być w tej kąpieli zanurzony. Po kilkunastu minutach srebro odzyskuje blask, wyjmujemy je, płuczemy i jest. Wiecie już dlaczego to działa?
No to teraz obejrzymy fotki:






