Jak oczyścić białko? cz.6
Do oczyszczania białek użyć można bardziej wyrafinowanych rozwiązań opartych o wcześniej przedstawione przepuszczanie roztworu przez kolumnę. Takim ulepszeniem jest wysokociśnieniowa chromatografia ciśnieniowa HPLC (z ang. high-pressure liquid chromatography).
Różnica tkwi w bardziej rozdrobnionym materiale wypełniającym kolumnę. Zwiększa to tym samym miejsca oddziaływania, co przekłada się na większą zdolność rozdzielczą. Drobniejszy nośnik w kolumnie skutkuje tym, że aby uzyskać odpowiednią szybkość przepływu trzeba zastosować podwyższone ciśnienie. Efekt to duża rozdzielczość i szybki rozdział.
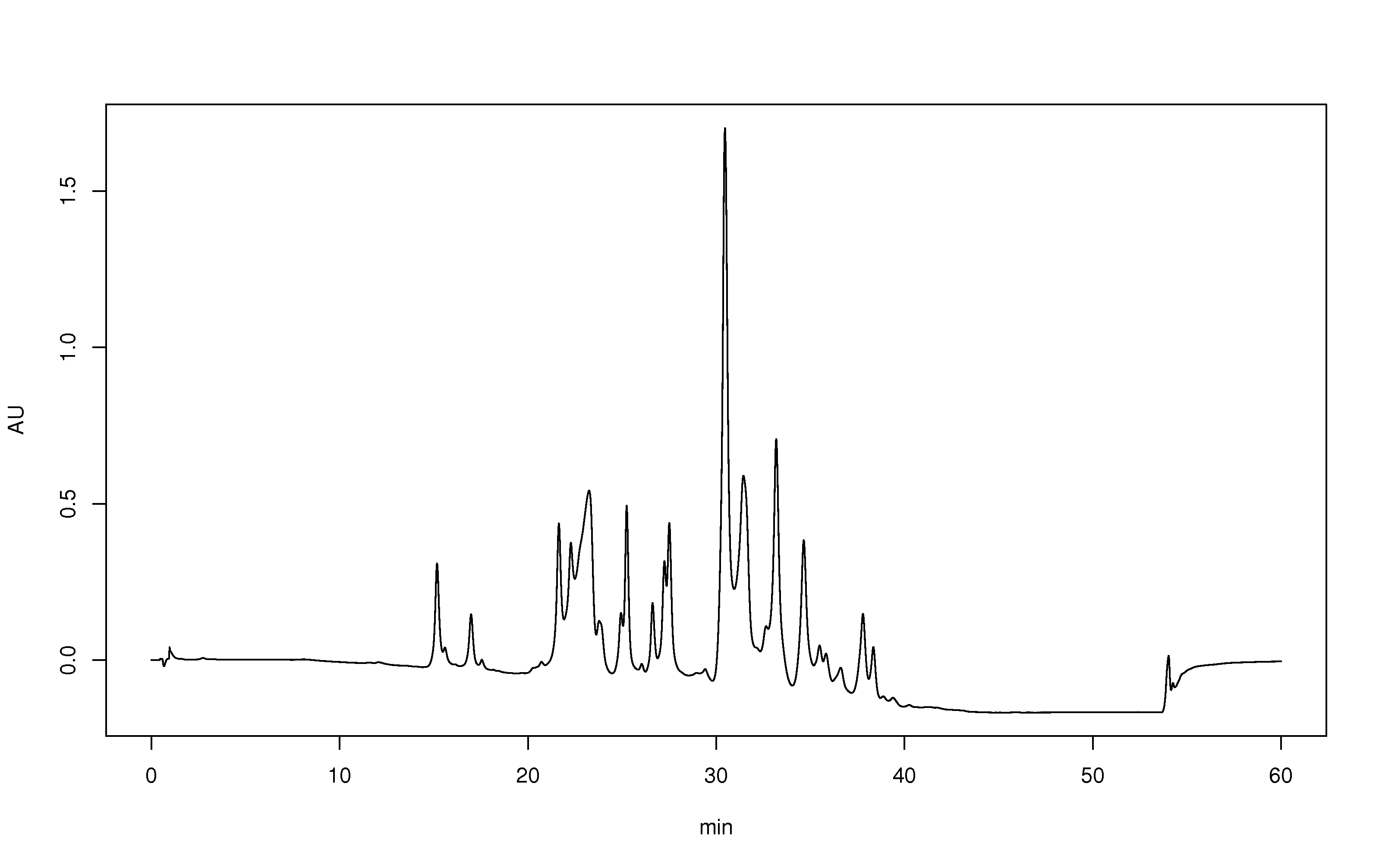 Wynik otrzymany po zastosowaniu metody HPLC – chromatogram złożonej mieszaniny otrzymanej tą techniką (w tym przypadku chodzi o perfumy)
Wynik otrzymany po zastosowaniu metody HPLC – chromatogram złożonej mieszaniny otrzymanej tą techniką (w tym przypadku chodzi o perfumy)
Źródło: wikipedia.pl
Prowadzenie oczyszczania HPLC wygląda podobnie jak inne chromatografie kolumnowe. Próbkę rozpuszcza się w odpowiednim rozpuszczalniku (może to być metanol, chlorek metylenu, toluen, etanol, acetonitryl, bufory) i jako roztwór o znanym stężeniu i objętości wlewa się do kolumny. Nośnikiem jest żel lub złoże porowate. Rozdział następuje w wyniku oddziaływań pomiędzy cząsteczkami w związku chemicznym z badanej próbki, a wypełnieniem kolumny. Oczywiście jeśli analizowane związki mają większe powinowactwo do złoża, a mniejsze do fazy ruchomej (rozpuszczalnika w którym się znajdują) przepływają wolniej przez kolumnę.
Novum jest tu obecność dość wysokiego ciśnienia w kolumnie, rzędu 100 atm. Wynika ono z:
-> wąskiego przekroju kapilar pomp HPLC,
-> kilkumikrometrowej średnicy ziaren wypełniających kolumnę,
-> przepływu fazy ruchomej, do kilkudziesięciu ml/min.
Dużą zaletą w porównaniu z tradycyjną chromatografią są:
-> lepsze parametry sprawności i rozdzielczości układu HPLC, a to przekłada się na
-> znacznie krótszy czas uzyskania rozdziału badanych mieszanin na oczyszczone związki chemiczne (typowo analiza jednej próbki zajmuje kilka – kilkadziesiąt minut).
Jako wynik otrzymujemy wykres, gdzie na osi y podana jest absorbancja przy danej długości fali, a na osi x – mijający czas. Obserwowane piki (szczyty na wykresie) przy danej długości fali wskazują na wartość absorbancji, która charakteryzuje dość jednoznacznie badane białka (lub inne związki). Dla przykładu, przy 220 nm:
A = 0,196 odpowiada tyreoglobulinie,
A=0,1 – katalazie lub albuminie z surowicy bydlęcej,
A=0,210 wskazuje na rybonukleazę.
Przy czym przy interpretacji bierze się pod uwagę czas pomiaru i wielkość białka (w kDa).
Technika ta umożliwia zatem oczyszczanie, badanie i identyfikowanie substancji chemicznych.