Strach ma wielkie oczy – stopnie utlenienia i związki organiczne
Zapraszam także na lekcję nagraną: bilansowanie reakcji redoks metodą jonowo-elektronową, w tym związków organicznych . Naciśnij tutaj po szczegóły.

Z pojęciem reakcji utleniania i redukcji spotykamy się przecież już w szkole średniej. Dla wielu osób opanowanie sztuki ich bilansowania stanowi początkowo problem, jednakże jak się okazuje – jeszcze większy problem stanowi bilansowanie reakcji z udziałem związków organicznych. A przecież zasady obliczania stopnia utlenienia czy bilansowania nie zależą od zaszufladkowania związku do organicznych lub nieorganicznych.
Kulejąca edukacja
Na którym stopniu utlenienia jest azot w grupie nitrowej? To pytanie często pojawia się na forach, z związku z kłopotami w zbilansowaniu reakcji redukcji nitrobenzenu do aniliny. Pewnym paradoksem jest, że gdy kazać uczniom/studentom obliczyć stopnie utlenienia w związku czy nawet jonie, ale nieorganicznym – to zrobi to bez problemu. Gdy jednak zapytać te same osoby, co to jest stopień utlenienia, to większość osób, które poprawnie obliczyły stopnie utlenienia nie potrafi odpowiedzieć. Co więc policzyły? Dlaczego robią coś automatycznie nie potrafiąc powiedzieć, co policzyły? Gdy jednak pokazać tym osobom, które świetnie poradziły sobie ze związkiem nieorganicznym, związek organiczny i kazać obliczyć stopnie utlenienia np. atomu węgla, to pojawiają się zagwozdki i trudności. Dlaczego? Co więcej, dotyczy to tych osób, które nie potrafią odpowiedzieć na pytanie czym jest stopień utlenienia, ale o dziwo potrafią go obliczać przynajmniej dla pewnej grupy przypadków nieorganicznych. Jaka jest tego przyczyna, że nie wiedząc czym jest stopień utlenienia, gro ludzi potrafi go obliczyć? Przyczyna wydaje się dość prosta: większość ludzi nie rozpatruje budowy związku, wiązań, tylko kieruje się zasadą, że tlen zawsze na –II (lub -2, zależnie od notacji), a wodór na I. Oczywiście poza tzw. wyjątkami, a jak wiadomo rzekomych wyjątków wciska się w szkolnym kanonie edukacji chemicznej bardzo dużo. A przecież nie są to żadne wyjątki! Tak więc każąc komuś określić stopnie utlenienia masa ludzi kieruje się zasadą, że suma musi wynosić zero, tak więc oblicza go z różnicy, a jakimś dziwnym trafem szkolne przykłady prawie zawsze dotyczą oklepanych związków tlenowych. Czy nie ma w układzie okresowym innych pierwiastków tworzących związki nieorganiczne, niż tlen i paru jego kolegów? Tak więc apeluję, w imię lepszej edukacji chemii, aby tłumaczyć ideę pojęcia stopnia utlenienia w taki sposób, aby nie rozleniwiać ludzi i przyzwyczajać ich do obliczania stopnia utlenienia metodą sumowania, a przy okazji pozwalając im zapominać co tak naprawdę liczą. Czyli tak, by zamiast liczyć, przyjrzeli się budowie cząsteczki lub jonu. Bo przecież to co często robią ludzie to analogiczna sytuacja jak obliczenie przeciwprostokątnej z twierdzenia Pitagorasa – podstawimy i policzymy, nawet jeśli nie wiemy jak wygląda trójkąt.
Co to jest stopień stopień utlenienia?
Zacznijmy od początku – żeby zbilansować reakcję redoks najpierw trzeba ustalić stopnie utlenienia. Co prawda i bez tego się da, jeśli ma się pewną wprawę, ale szkolna rutyna zakłada ich obliczanie. Już samo pojęcie „stopnia utlenienia” jest problematyczne, bo jest po prostu niezbyt dobrze uczone, a wszystko co jest źle uczone jest źródłem błędów, przekłamań i zwykłych herezji, których w podręcznikach szkolnych nie brak. Co to właściwie jest stopień utlenienia i jak się nim posługiwać? Definicja, którą pamiętam słowo w słowo z liceum, brzmi:
„Taki ładunek, jaki posiadałby atom, gdyby wszystkie wiązania tworzone przez niego miały charakter jonowy”
Zwróćmy uwagę na słowo posiadałby – już samo to wskazuje, że jest to coś, co w rzeczywistości nie musi istnieć, bo większość związków tworzy wiązania tylko kowalencyjne, albo z niewielką domieszką jonowych, weźmy np. jakieś mydło, C17H35COONa, spośród wszystkich 57 wiązań tylko jedno ma charakter jonowy, a każdy z 56 atomów posiada stopień utlenienia.
Sens stopnia utlenienia na przykładzie prostych związków jonowych
Skupmy się na razie na chlorku sodu, bo jest to przecież substancja chemiczna, która nam towarzyszy jako sól kuchenna. Ma ona słony smak, ale słony smak ma także chlorek potasu KCl (znajduje się w soli o obniżonej zawartości sodu) czy chlorek wapnia CaCl2 i MgCl2. Oczywiście smak każdego chlorku nie jest taki sam, np. CaCl2 ma smak gorzko-słony, ale łączy je jedna cecha – wszystkie są słone. Zadajmy sobie zatem pytanie – a dlaczego? Wyobraźmy sobie reakcję syntezy chlorku sodu z pierwiastków:

Dla pewnego ułatwienia zapiszmy reakcję pojedynczego atomu chloru:

Czym jednak jest powstały związek i jak jest zbudowany? Nie przez przypadek wspomniałem o słonym smaku związków chloru z kilkoma aktywnymi metalami. Przyjrzyjmy się tabeli poniżej:

Pamiętajmy, że pierwiastki chcą mieć konfigurację gazu szlachetnego, dlatego podałem uproszczony jej zapis. Sód posiada tylko jeden elektron walencyjny – jeśli go odda, będzie miał konfigurację neonu. Chlor z kolei ma ich 7 – jeśli przyjmie jeden, to osiągnie konfigurację argonu. Żeby osiągnąć konfigurację neonu, musiałby ich oddać 7. Zdecydowanie łatwiej jest przyjąć lub oddać jeden, niż np. 7. Chlor ma więc tendencję do przyjęcia elektronu, podczas gdy sód do jego oddania, co widać także po elektroujemności – sód ma małą skłonność do przyciągania swojego elektronu walencyjnego, z kolei chlor ma dużą skłonność do przyciągania swoich siedmiu. No dobrze, co więc się stanie jeśli sód i chlor wejdą w reakcję ze sobą? Chlor przejmie elektron walencyjny od sodu. Powstaną zatem dwa jony: Na+ i Cl-, a wiele takich jonów utworzy sieć krystaliczną chlorku sodu:

Pomiędzy jonami istnieje tylko oddziaływanie elektrostatyczne, zwane wiązaniem jonowym. Przyjrzyjmy się teraz definicji stopnia utlenienia:
„Taki ładunek, jaki posiadałby atom, gdyby wszystkie wiązania miały charakter jonowy”.
Mamy szczęście, bo w przypadku NaCl wszystkie wiązania to tylko jedno wiązanie, a do tego jonowe z natury. Sód ma więc stopień utlenienia I (lub +1) a chlor na –I (lub -1). Wolne pierwiastki nie posiadały ładunku ani nie tworzyły jeszcze wiązań pomiędzy sobą, więc przed reakcja oba posiadały stopień utlenienia równy 0. Albo jeszcze: NaCl składa się z jonów Na+ i Cl- a nie Na- i Cl+ z tej przyczyny, że chlor jest znacznie bardziej elektroujemny. Jonowe są także inne wspomniane chlorki: KCl, CaCl2 czy MgCl2 – słony smak wszystkich z nich spowodowany jest obecnością anionu chlorkowego we. Słonego smaku nie posiada natomiast CCl4, mimo że także zawiera chlor. Ale na tym związku skupimy się trochę później.
Dobrze, w przypadku NaCl mieliśmy szczęście. A co w innych przypadkach? Porównajmy ze sobą dwa pierwiastki tworzące związek, ale przy mniejszej różnicy elektroujemności pomiędzy nimi. Na początek weźmy chlor i wodór:
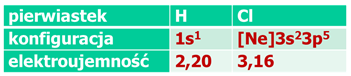
Tutaj różnica elektroujemności jest mniejsza, bo wodór nie pozwala tak łatwo osobie odebrać elektronu – swojego jedynego. I choć chlor chce, to jednak nie bardzo może, bo jakimiś resztkami sił wodór trzyma swój elektron. Chlor i wodór utworzyły więc wiązanie, przez uwspólnienie elektronów – utworzyły wiązanie kowalencyjne, czyli wiązanie chemiczne z prawdziwego zdarzenia. Zauważmy jeszcze coś, oba pierwiastki potrzebują zaledwie jednego elektronu by osiągnąć konfigurację gazu szlachetnego. Z tego też powodu wodór ma zdecydowanie wyższą elektroujemność niż reszta pierwiastków z pierwszej grupy, ale jednocześnie nie na tyle wysoką, by szczególnie mocno trzymać ten elektron. W wiązaniu kowalencyjnym elektrony są uwspólnione i krążą wokół obu jąder, ale chlor ściąga elektrony silniej – co jest tego konsekwencją? To, że wiążąca para elektronowa nie jest równomiernie rozłożona pomiędzy jądrami atomowymi wodoru i chloru, tylko jest przesunięta bardziej na chlor, elektrony z wiążącej pary więcej czasu spędzają na atomie chloru niż wodoru. Czyli w tej parze chlor ma przewagę ładunku ujemnego, zaś jądro wodoru jest częściowo odsłonięte więc, a jego ładunek dodatni nie jest w pełni równoważony przez elektrony, które lepiej nieco czuja się na atomie chloru. Ale uwaga! Nie jest to całkowity ładunek! Całkowity ładunek elementarny uzyskalibyśmy, gdyby wiążąca para całkowicie przeskoczyła na atom chloru. Otrzymali byśmy wtedy dwa jony: H+ i Cl-, czyli tak, jak to by miało miejsce w związku jonowym (NaCl, KCl itp.). Ładunki takie jak w cząsteczce HCl zwiemy cząstkowymi (lub bardziej z języka obcego parcjalnymi, ale ponieważ słowo parcja w języku polskim praktycznie nie występuje, to konsekwencją jest używanie słowa cząstkowy, a nie parcjalny, jak nieraz próbują wybiegać przed szereg medycy). Ładunki cząstkowe oznaczamy literką δ. Cząsteczka posiada więc bieguny: dodatni δ+ (wodór) i ujemny δ– (na chlorze).

Zobaczmy jeszcze na rysunek uwzględniający gęstość elektronową:
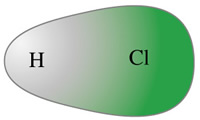
Kolor zielony oznacza większą gęstość na atomie chloru. Dla porównania jeszcze raz NaCl, czyli związek jonowy:

O wiązaniu, którego elektrony nie są symetrycznie rozłożone pomiędzy dwa jądra atomowe mówimy, że jest spolaryzowane, zaś cząsteczki posiadające niesymetrycznie rozłożone ładunki i posiadające z tego powodu bieguny elektryczne nazywamy polarnymi (dipolami). Czy jest możliwy taki przeskok wiążącej pary elektronowej, by otrzymać jony posiadające całkowite ładunki elektryczne? Oczywiście że tak! Przecież w wodzie taki HCl chętnie dysocjuje na z utworzeniem jonów H+ i Cl–. Oczywiście H+ to forma uproszczona, bo poprawniej jest H3O+. A woda? Też przecież jest polarna! Tam także dochodzi do sytuacji, że para elektronowa całkowicie przeskoczy na tlen, wo końcu woda także dysocjuje z odszczepieniem jonu H+,i pozostanie jon OH–. Tyle że tylko jedna z milionów cząsteczek wody dysocjuje, czyli prawdopodobieństwo przeskoku pary i utworzenia jonów jest niewielkie. A jak to się przenosi na stopnie utlenienia? Gdyby wiązanie pomiędzy H i Cl było jonowe, to HCl byłby związkiem podobnym do NaCl i byłby podobnie jak on byłby kryształem zbudowany z jonów H+ i Cl–. Nie jest jonowy, ale zdolność do dysocjacji jonowej posiadają związki kowalencyjne w wiązaniami spolaryzowanymi, a wiec i HCl. Gdyby z kolei woda było związkiem jonowym, to składała by się z jonów H+ i O2– w stosunku 2:1. Jakie stopnie utlenienia miałaby poszczególne pierwiastki, gdyby HCl i H2O były substancjami jonowymi? Wodór byłby zarówno w wodzie i chlorowodorze na I, Cl na –I, a tlen na –II.
A teraz dla przykładu rozpatrzymy kilka innych związków kowalencyjnych węgla.

Wynika stąd, że w CCl4 węgiel jest na IV stopniu utlenienia, a chlor na –I. Z kolei w CH4 węgiel przyjmuje –IV stopień utlenienia. A co zrobić w sytuacji, gdy węgiel wiąże się zarówno z jednym i drugim? Zobaczmy:
H→C→Cl
Gdyby nastąpiła dysocjacja elektrolityczna wiązania C-H, to węgiel zabrałby elektron od wodoru, a gdyby oddysocjował chlor, to razem z elektronem od węgla i węgiel wyszedłby na tym na zero. Przyjrzyjmy się tabelce:

Czy już potrafimy powiedzieć, dlaczego akurat takie a nie inne przykłady są przypisane do danego stopnia utlenienia? Ale uwaga, nie obliczajmy na podstawie sumowania do zera, tylko określajmy go na podstawie budowy!
Tetrachlorek węgla – kwestia smaku
Dlaczego w przeciwieństwie do wcześniej wymienionych chlorków, CCl4 nie ma słonego smaku? Ano z tego powodu, że wiązanie C-Cl jest mniej spolaryzowane niż np. H-Cl – wcale chętnie nie dysocjuje, jest wręcz pomijalna zdolność tego wiązania do dysocjacji. CCl4 w żadnym przypadku nie przypomina chlorków o budowie jonowej, w temperaturze pokojowej jest cieczą o słodkim zapachu i słodkawym smaku – bo na nasze kupki smakowe nie trafiają aniony chlorkowe. Praktycznie nie rozpuszcza się też w wodzie. A dlaczego mimo spolaryzowanych wiązań C-Cl się bardzo słabo miesza z wodą to wymagało by to wprowadzenia jeszcze jednego pojęcia, ale to nie wniosłoby nic do naszego tematu, bo celem jest stopień utlenienia.
Wiązania pomiędzy atomami tego samego pierwiastka
Pozostaje do wyjaśnienia jeszcze kwestia wiązań pomiędzy atomami tego samego pierwiastka. Wiemy już, że pierwiastki w stanie wolnym mają zerowy stopień utlenienia. Ale są i związki w których mamy wiązania pomiędzy atomami tego samego pierwiastka, np. z co w przypadku, gdy weźmiemy nadtlenek wodoru H2O2?
Spójrzmy na jego strukturę Lewisa:

Po oddysocjowaniu obu H+ otrzymalibyśmy anion nadtlenkowy –O-O–:

ale co zrobić z wiązaniem pomiędzy atomami tlenu? Przecież oba mają identyczna elektroujemność! Nie ma wiec zbytnio innej rady jak rozdzielić elektrony symetrycznie i otrzymamy dwa aniony O-:
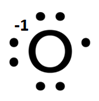
Otrzymamy w ten sposób 2 aniony O– (a właściwie rodnikoaniony, bo posiadają niesparowany elektron). Wynika z tego, że tlen ma tutaj stopień utlenienia –I, a zauważmy, że i bez rozbijania jonu –O-O– można do tego już dojść, gdyż tlen ma i tak ładunek -1. Celowo wspominam tutaj o wiązaniu O-O, gdyż w związkach organicznych zazwyczaj pojawia się wiązanie C-C, ale jak postaram się pokazać, nie ma znaczenia czy związek jest organiczny, czy też nie, bo podział na związki organiczne i nieorganiczne wprowadzili sami ludzie, choć niekoniecznie na tym dobrze wychodzą – za bardzo co niektórzy trwają w podziałach, a za mało patrzą na chemię jak na zwięzłą naukę. Zatem tak jak tlen w H2O ma –II stopień utlenienia, a węgiel w CH4 ma –IV, tak tlen w H2O2 ma –I, a węgiel w C2H6 ma –III, czyli w obu przypadkach o jeden wyższy z powodu obecności wiązania pomiędzy atomami tego samego pierwiastka. Po oddysocjowaniu wszystkich protonów z C2H6 zostanie nam jon C26-, który możemy rozbić na dwa aniony C3-. Zatem stopień utlenienia węgla wynosi –III.
Czy stopień utlenienia zawsze jest liczbą całkowitą?
Czy stopień utlenienia może być ułamkowy? I nie, i tak. Wynika to stąd, że w niektórych przypadkach można podać ładunek przypadający w przeliczeniu na 1 atom, choć nie odda to rzeczywistości, bo przecież elektronu nie da się podzielić na ułamki i rozdysponować pomiędzy jakieś atomy. Rozpatrzmy więc taki przykład, ponadtlenek potasu KO2. Związek ten jest budowy jonowej, składa się więc z jonów K+ (tutaj stopień utlenienia jest dla nas oczywisty), ale co zrobić z tlenem? Mamy tutaj jon –O-O•, gdzie • oznacza niesparowany elektron. Gdybyśmy zdysocjowali ten jon, to otrzymalibyśmy O– i obojętny elektrycznie atom O. Co z tego wynika? Ze jeden atom tlenu ma stopień utlenienia –I, a drugi 0. Ale! Ze względów praktycznych, by np. ułatwić sobie bilansowanie reakcji, możemy uśrednić stopień utlenienia i przyjąć, że zarówno pierwszy jak i drugi atom tlenu mają -1/2 stopień utlenienia. Jednakże, nie należy się sugerować, że rzeczywiście tak jest. O dziwo, jak potem postaram się wykazać – taki zabieg moglibyśmy zrobić dla całkiem skomplikowanych związków zawierających wiele atomów węgla i nadal poprawnie zbilansować równanie reakcji redoks. Niestety, w określaniu stopni utlenienia zdarzają się pewne niekonsekwencje w podręcznikach, ale o tym też przy innej okazji.
Jak już ustaliliśmy, stopień utlenienia nie jest pojęciem odnoszącym się do rzeczywistości, gdyż tylko nieliczne substancje zbudowane z jonów prostych odzwierciedlają ideę tego pojęcia. Dla większości przypadków natomiast jest to pojęcie abstrakcyjne – patrzymy tylko na to, który pierwiastek silniej ściąga elektrony i przyjmuje cząstkowy ładunek ujemny, a który cząstkowy ładunek dodatni. Cząstkowego ładunku nie należy mylić z ładunkiem ułamkowym wynikającym z uśrednienia ładunku pomiędzy pewną ilość atomów, jak zrobiliśmy w przypadku ponadtlenku! Cząstkowy ładunek oznacza, że para elektronowa jest przesunięta w stronę pierwiastka bardziej elektroujemnego, powodując, że jądro atomowe pierwiastka mniej elektroujemnego jest nieco odsłonięte wskutek częściowej utraty jednego elektronu, bo przebywa on chętniej w pobliżu atomu o większej elektroujemności, dając mu przy okazji cząstkowy ładunek ujemny. Gdyby oczywiście taki bardziej elektroujemny pierwiastek całkowicie zabrał elektron pochodzący z innego atomu, to otrzymamy 2 jony: kation (który wcześniej posiadał tylko dodatni ładunek cząstkowy) i anion (który także posiadał cząstkowy ładunek przedtem, ale ujemny). To właśnie występowanie ładunków cząstkowych nadaje cząsteczkom polarności, np. wodzie, w której wodór posiada cząstkowy ładunek dodani δ+, a tlen ujemny, ale o wartości 2δ– (a dlaczego jest 2 razy większy?:)).
Ale wprowadźmy trzeci atom węgla: CH3-CH2-CH3, czyli propan. Środkowy atom węgla ma dwóch sąsiadów będącymi też atomami węgla. Po obliczeniu stopni utlenienia dla węgla kolejno otrzymamy: -III, -II, -III. Gdybyśmy chcieli podać średni stopień utlenienia węgla w tym związku, to otrzymalibyśmy –II2 ⁄3.
Ćwiczenie 1: Określić stopnie utlenienia wszystkich atomów węgla w następujących związkach: (CH3)4C, C2H2, C6H6,
No to skomplikujmy sobie jeszcze trochę i policzmy stopień utlenienia węgla w metanolu CH3OH. Wiązanie C-H to już wiemy, ale co z wiązaniem C-O? Znowu patrzymy na elektroujemność atomów i widzimy, że tlen ma znacznie wyższą, czyli to on ściąga elektrony do siebie. No to zobaczmy co by było, gdyby wszystkie wiązania w cząsteczce metanolu zdysocjowały elektrolitycznie: 4H+, O2-, a co z C? Węgiel dostał 3 elektrony od wodoru, ale tlen oddysocjował zabierając mu jeden. Inaczej możemy powiedzieć, że węgiel ściągnął na siebie 3 pary wiążące z wodorem, a tlen odszedł z parą wiążącą – pamiętajmy, że para wiążąca składa się z elektronów pochodzących od obu atomów, po jednym od każdego. Niezależnie od tego jak to rozpatrzymy, to i tak otrzymamy, że trzecim jonem byłby C2-, czyli stopień utlenienia węgla wynosi –II.
Ćwiczenie 2: określić stopnie utlenienia wszystkich atomów węgla w następujących alkoholach: etanol, 1-propanol, 2-propanol
Ok, przejdźmy teraz do jakiejś aminy. Najprostszą aminą jest oczywiście amoniak NH3, w którym azot jest na –III stopniu utlenienia. A co się stanie, jeśli jeden z atomów wodoru podstawimy grupą metylową? Czy dla azotu coś się zmieni? Sprawdźmy. Elektroujemność azotu wynosi 3,04, węgla 2,55, czyli polaryzacja wiązania C-N jest taka sama jak H-N, bo azot silniej ściąga elektrony. Już bez rozpisywania się, łatwo możemy policzyć, że stopień utlenienia węgla wynosi –II, czyli jest taki sam jak w metanolu. W końcu tak naprawdę zamieniliśmy grupę OH na NH2, a ponieważ polaryzacja wiązania C-O jest taka sama C-N, to z perspektywy węgla nic się nie zmieniło. I jakiej aminy byśmy nie wzięli – zawsze otrzymamy –III dla azotu, pod warunkiem, że zostanie zachowana polaryzacja wiązań
Ćwiczenie 3: określić stopień utlenienia azotu w hydroksyloaminie HONH2. Skąd wynika różnica w stopniu utlenienia azotu w porównaniu z metyloaminą H3CNH2?
No dobrze, rozpatrzmy metanal, czyli CH2O. Jeśli tutaj policzymy wszystko dobrze, to otrzymamy, że węgiel jest na zerowym stopniu utlenienia. Tak, okrągłe 0. Można sobie teraz wyobrazić abstrakcyjność tego pojęcia, gdyby bowiem nam to wszystko elektrolitycznie zdysocjowało, to mielibyśmy zupę, w której pływałyby kationy H+, aniony O2- a pomiędzy nimi obojętne atomy węgla też by sobie pływały… Przy okazji widać jak na dłoni, że stopień utlenienia to nie to samo co wartościowość, a tak twierdzą niektórzy nauczyciele! Przecież we wszystkich omawianych do tej pory związkach węgiel jest czterowartościowy, a jakie przyjmuje stopnie utlenienia? Też IV zawsze? A tlen w H2O i H2O2 ile jest wartościowy i czy to odpowiada jego stopniom utlenienia?
Ćwiczenie 4: Obliczyć stopnie utlenienia wszystkich atomów węgla w kwasach karboksylowych: HCOOH, CH3COOH, H2N-CH2COOH, H2N-COOH, CF3COOH, ClCH2COOH.
A teraz poruszymy przypadki szczególnie kłopotliwe dla uczniów i dla samych nauczycieli, w tym, jak się rok temu okazało, także dla niektórych egzaminatorów maturalnych. Przypadki te, co rusz można znaleźć na forach i grupach. Zaczniemy od kwasu azotowego(V) i nitrozwiązków. Najpierw kwas azotowy(V) HNO3, jak informuje cyfra rzymska w nawiasie – azot jest na piątym stopniu utlenienia. Za pomocą kwasu azotowego, jego mieszanin z kwasem siarkowym czy innymi kwasami, a także za pomocą jego soli można nitrować, czyli wprowadzać grupę nitrową NO2 do innej cząsteczki. I teraz standardowe pytanie: jaki jest stopień utlenienia azotu w grupie nitrowej? Na forach często można spotkać bicie piany o to i wyzywanie jednych i drugich od ignorantów. Jedni bowiem twierdzą, że V, bo przecież pochodzi od HNO3, inni twierdzą, że z obliczeń im wychodzi III. Co kryje prawda? Zobaczmy, rozpatrzmy chociażby nitrometan CH3NO2. Alkany można nitrować w fazie gazowej parami kwasu azotowego:

UWAGA: niektórzy przyjmują, że stopień utlenienia azotu w aminach pierwszorzędowych wynosi –II, a w nitrozwiązkach IV. Choć nie jest do końca zgodnie z zasadami obliczania stopnia utlenienia, to jednak założenie takie pozwala nadal poprawnie zbilansować reakcję redukcji nitrozwiązków do amin, bo nadal widać, że w reakcji ulega wymianie 6 elektronów!
Ćwiczenie 5: Obliczyć stopień utlenienia węgla i siarki w kwasie metanosulfonowym CH3-SO3H. Czy sulfonowanie za pomocą kwasu siarkowego także jest reakcją redoks?
Zostańmy na chwilę jeszcze przy nitrozwiązkach. Tym, którzy tak się lubią upierać, że azot tam ma piątym stopień utlenienia, polecam niech zbilansują reakcję redukcji wodorem nitrozwiązków do amin:
![]()
Kolejna sprawa, to fakt, że nitrozwiązki wcale nie muszą być otrzymywane w reakcji nitrowania! Można je otrzymywać używając soli kwasu azotowego(III) w reakcji substytucji nukleofilowej, np:

Przecież gdyby wiązanie C-N w takim CH3-NO2 nam zdysocjowało, to otrzymalibyśmy CH3+ i NO2–, prawda? Dziwnym zbiegiem okoliczności ten sam anion mają sole kwasu azotowego(III)… A teraz coś dla poćwiczenia:
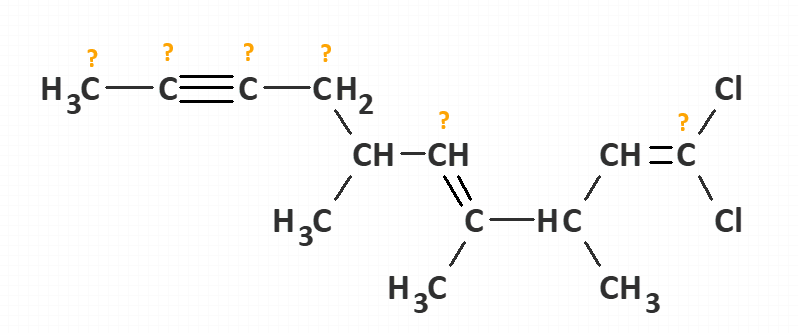
Ćwiczenie 6: określić stopnie utlenienia wszystkich atomów z pominięciem wodoru w podanych związkach: a) CH3Cl, b) CH3CH2CH2-NO2, c) CH3CH2CH2-O-NO, d) CH3-NO2, e) CH3-O-NO2, f) C6H5-NO2, g) C6H5-SO3H, h) C6H5-O-SO3H, i) C10H8 (naftalen), j) CH3NH2, k) C6H5NH2, l) CH2O, m) CHOCl, n) COCl2, o) CO2, p) CCl4, q) COS (S=C=O), r) CH3-O-O-H, s) CH3-O-O-CH3, t) CH3-S-S-CH3, u) CBr2ClF
Odpowiedzi znajdują się na ostatniej stronie numeru drugiego naszego czasopisma. DM.
Link do czasopisma online:
Witam
Twoje podejście do tematu nauczania jest normalne a jeszcze bardziej chwała ci za to że masz odwagę to robić, przeciw naukowym dogmatom. Moje pytanie co się może działać z azotem w obecności wody o redox – 250 mv. W obecności stli chromoniklowej i aluminium manipulacji potencjalem el i czestotliwoscia. temat joecell.