Tajemnica amfoteryczności – wodorotlenki amfoteryczne
Pojęcie amfoteryczności lubi sprawiać pewne kłopoty. Zwykle nauczyciele każą zapamiętać kilka tlenków jako amfoteryczne. Oraz o dziwo, czasem nawet o metalach amfoterycznych się mówi. Jednakże z czym tak naprawdę wiąże się amfoteryczność i czy są na to jakieś reguły? Na szczęście są. Ale rzadko się o tym mówi, przez co amfoteryczność sprawia zazwyczaj duży kłopot wielu uczniom. Ze szkoły znamy zazwyczaj tlenki i wodorotlenki Al, Zn a czasem Pb, Cr i być może inne, zwykle każe się nauczyć na pamięć kilku tlenków jako amfoteryczne.
Związki amfoteryczne znane są z tego, że reagują zarówno z kwasami jak i zasadami. Są jakby chemicznymi obojnakami, a obojnaki, jak zapewne pamiętamy z biologii, to nie są organizmy bezpłciowe, tylko organizmy wykazujące cechy obu płci naraz. Równocześnie są samcem i samicą, nie są jednak bezpłciowe. Bezpłciowe tlenki, czyli tlenki obojętne, też są, należą do nich np. CO, który nie wykazuje cech swojej chemicznej płci, czyli ani zasadowego, ani kwasowego charakteru. Jeśli związek amfoteryczny umieścić w środowisku silnej zasady, to związek ten zachowa się jak kwas i w wyniku reakcji powstanie sól, w której reszta kwasowa będzie pochodzić od związku amfoterycznego. Natomiast w środowisku silnego kwasu zachowa się jak zasada i powstanie sól, w której kationem będzie metal budujący związek amfoteryczny. Zazwyczaj w szkole na tym kończy się rozmowa, że taki przykładowy Al(OH)3 roztwarza się w nadmiarze zasady itp. Jednakże z powodu zachowania tych związków, wodorotlenki amfoteryczne można potraktować w reakcji z zasadami jako kwasy tlenowe i zapisać tak ich wzory, np: H4PbO4 zamiast Pb(OH)4.
UWAGA, aby dobrze zrozumieć wszystkie zagadnienia opisane poniżej, należy mieć przy sobie układ okresowy pierwiastków i pracować z nim w miarę czytania tekstu niżej.
Jednakże wiązki amfoteryczne tworzą się wg pewnych reguł. Weźmy pod lupę budowę układu okresowego: z lewa na prawo rosną właściwości kwasowe tlenków, pierwiastki skrajnie po lewej stronie (I grupa) tworzą tlenki zasadowe które reagując z wodą dają zasady, pierwiastki skrajnie po prawej (oczywiście nie gazy szlachetne) tworzą tlenki kwasowe, a to oznacza, że gdzieś pomiędzy nimi są tlenki które mają zbliżone udziały jednego i drugiego charakteru. Tak, tlenki amfoteryczne mają zbliżone udziały właściwości kwasowych i zasadowych. Jeśli popatrzymy na np. sód, to zauważymy, że leży skrajnie po lewej i że daje wodorotlenek, będący mocną zasadą, następnie za nim leży Mg, który daje również wodorotlenek, ale… ten już nie jest mocną zasadą (bo ma większy udział własności kwasowych od sąsiada), następny z kolei jest glin, który daje wodorotlenek będący jeszcze słabszą zasadą ale o dziwo reagujący z mocnymi zasadami, tak jak czynią to typowe kwasy. Następny w kolejce jest krzem, który daje tlenek reagujący z zasadami, ale niereagujący z kwasami. Dzieje sie tak dlatego, że tlenek glinu ma mniej więcej zbliżone udziały właściwości kwasowych i zasadowych, natomiast tlenek krzemu ma już przewagę właściwości kwasowych nad zasadowymi. Następny w kolejce jest fosfor, który daje tlenki o typowo kwasowym charakterze, natomiast o zasadowym charakterze tlenków siarki nie ma co rozprawiać, bo wiemy że że takich nie posiadają (ściślej: udział właściwości zasadowych jest zaniedbywalnie mały, nie mają one wpływu na reakcje tych tlenków z kwasami czy zasadami). Ot, odsłonilismy pierwszy rąbek tajemnicy. Pamiętajmy, że nie ma tlenków w 100% zasadowych lub kwasowych, tylko co najwyżej ich jeden charakter w bardzo dużym stopniu dominuje nad drugim.
Powiążmy teraz charakter tlenków z położeniem w grupie i przy okazji elektroujemnością pierwiastka. Jak zapewne pamiętamy (mam taką nadzieję), charakter metaliczny w grupie rośnie ze wzrostem masy atomowej, czyli w kierunku „w dół” na chłopski rozum. Rozpatrzmy grupę 13. na początek: B, Al, Ga, In, Tl. Bor jest niemetalem i tworzy tlenek o kwasowym charakterze, glin jest już metalem i tworzy tlenek o właściwościach zarówno kwasowych jak i zasadowych natomiast każdy następny ma silniejszy charakter metaliczny (Ga, In, Tl) i tworzy tlenki o charakterze coraz bardziej zasadowym, np. Tl2O jest tlenkiem zasadowym. Teraz rozpatrzmy grupę drugą: Be, Mg, Ca, Sr, Ba, Ra. Beryl tworzy tlenek amfoteryczny (czyli o zbliżonym udziale charakteru kwasowego i zasadowego (a jaki tlenek daje pierwiastek na prawo od niego, czyli bor?), Mg daje tlenek o właściwościach zasadowych, jednak w reakcji z wodą powstaje słaby wodorotlenek, następny w kolejności jest Ca, który daje tlenek o zdecydowanie zasadowym charakterze i powstały wodorotlenek jest mocny, czyli jest bardziej zasadowy niż analogiczny Mg(OH)2. Każdy następny tworzy silniejszy wodorotlenek, np Ba(OH)2 ma moc porównywalną z KOH. Weźmy jeszcze grupę 16: S, Se, Te, Po. O siarce nie ma co dywagować, daje tlenki o charakterze kwasowym, selen także, jednakże, moc kwasów selenowych jest mniejsza niż analogicznych siarkowych. Jeszcze słabsze kwasy tworzy Te, gdyż w porównaniu z siarką jego charakter metaliczny jest już znacznie większy, w końcu pod nim jest już Po, zaliczany do metali, a sam polon daje tlenki o właściwościach amfoterycznych, czyli w jego przypadku charakter kwasowy i zasadowy jest zbliżony do siebie i tlenek wykazuje charakter amfoteryczny. A jak się to ma do elektroujemności?
Wodorotlenki amfoteryczne | Tlenki amfoteryczne
Jeśli przyjrzeć się temu co napisałem, to można zauważyć, że tlenki amfoteryczne mają dość zbliżone udziały wiązania kowalencyjnego spolaryzowanego i jonowego, czyli różnica elektroujemności oscyluje w pobliżu 1,7 (1,4 – 2.0).
Na rysunku poniżej przedstawiono zmiany charakteru tlenków, kolor niebieski oznacza tlenki zasadowe, zielony amfoteryczne a czerwony kwasowe, zwróć uwagę, na ilość tlenków amfoterycznych, a rysunek pomija grupy poboczne! Na rysunku uwzględniono maksymalne stopnie utlenienia.

Sprawdź też: układ okresowy z charakterem chemicznym tlenków, kliknij tutaj, aby pobrać w pełnym rozmiarze.
Zbliżona elektroujemność metal-tlen do wiązania O-H powoduje, że możliwe są dwie drogi dysocjacji elektrolitycznej, które decydują o tym, co nazywamy amfoterycznością. Zobaczmy jakie są 2 możliwe drogi dysocjacji wodorotlenku amfoterycznego, jakim jest Al(OH3), silnej zasady i analogicznego do niego kwasu fosforowego (III), fosfor sąsiaduje z glinem od prawej strony. Czarnymi kreskami zaznaczyłem możliwość rozerwania wiązań Al-O i O-H:
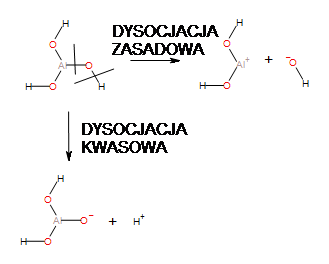
I kwasu fosforowego (III):

Pozostał nam do rozpatrzeni stopień utlenienia pierwiastka a charakter tlenku. Powinniśmy wiedzieć, że ze wzrostem stopnia utlenienia w tlenku rośnie jego kwasowość (a maleje zasadowość) i znowu w przypadku pierwiastków o kilku wartościowościach na średnich wartościowościach spotkamy się z sytuacją, że będą zbliżone udziały charakteru tlenku, czyli tlenek będzie wykazywał jeden i drugi charakter, taka sytuacja jest spotykana na średnich stopniach utlenienia. Na początek weźmy Mn, mający wartościowości: II, III, IV, V, VI, VII. Średnią wartościowością jest IV i można przypuszczać, że ten tlenek jest amfoteryczny (i rzeczywiście jest), natomiast każdy wyższy tlenek jest coraz bardziej kwasowy i w reakcji z wodą daje coraz to silniejszy kwas, aż do HMnO4, który jest kwasem o przyzwoitej mocy. A jak jest w przypadku siarki? Daje ona dwa tlenki: SO2 i SO3, silniejsze właściwości kwasowe ma SO3 i w reakcji z wodą daje też silniejszy kwas, gdyż przewaga właściwości kwasowych nad zasadowymi jest większa w przypadku tego tlenku. Jaka jest przyczyna wzrostu kwasowości przy wzroście stopnia utlenienia? Jak wiemy, pierwiastki różnią się siła przyciągania elektronów, czyli elektroujemnością. Wiązanie O-H jest spolaryzowane silnie, ze względu na wysoką różnicę elektroujemności i posiada zdolność dysocjacji elektrolitycznej. Wiązanie S-O nie jest aż tak polarne, bo różnica elektroujemności jest znacznie mniejsza. Tlen jednak jednak w układzie cząsteczki kwasu siarkowego najsilniej przyciąga elektrony, najsłabiej zaś wodór. Najbogatszy w elektrony jest tlen grupy OH, ze względu na silną polaryzację wiązania H-O. W gorszej sytuacji jest tlen wiązania S=O. Ten też stara się je przyciągnąć, może więc zabrać je siarce, para elektronowa wiązania podwójnego S=O może przeskoczyć na atom tlenu, przez co tlen ma oktet elektronowy, ale siarka będzie mieć ich niedomiar, co możemy zobaczyć na rysunku.

Bogaty w elektrony tlen grupy OH jest doskonałym donorem, by skompensować ładunek dodatni na siarce. Jeśli atom wodoru oddysocjuje jako H+, to jest możliwy przeskok pary elektronowej z naładowanego ujemnie tlenu w kierunku siarki, przez co siarka kompensuje swój ładunek. I teraz mamy niespodziankę, bo tlen, który początkowo tworzył podwójne wiązanie, teraz z kolei może przyłączyć oddysocjowany proton, gdyż ma ładunek ujemny, a tlen od którego przedtem odłączył się proton tworzy teraz podwójne wiązanie:


Takie zachowanie, związane z migracją ładunku wewnątrz cząsteczki, nazywa się rezonansem. Ponieważ elektrony przeskakują cały czas, powinniśmy na rysunku umieścić strzałki równowagi. Rzeczywista struktura jonu wodorosiarczanowego (IV) jest tak naprawdę uśrednioną postacią tych dwóch skrajnych form. W przypadku kwasu siarkowego (VI) mamy aż 2 atomy tlenu wyciągające elektrony od siarki, co sprawia, że ma ona bardzo dużą skłonność do zabierania ich z grup OH. Na pierwszym stopniu dysocjacji kwas siarkowy jest w pełni zdysocjowany. Podobne procesy mogą zachodzić także w wodorotlenkach amfoterycznych i kwasach metali, jak np. H2CrO4 czy HMnO4 oraz ich solach.
Gdyby porównać kwasowość MnO i CuO (tlenki metali z tego samego okresu), to ten pierwszy ma bardziej zasadowy charakter niż CuO, bo Mn leży bardziej po lewej stronie układu okresowego, ale można przypuszczać, że już Mn2O3 ma zbliżoną kwasowość do CuO (istotnie tlenki te wykazują zbliżony charakter ). Spośród Cu2O i Ag2O ten pierwszy jest silniej kwasowy niż Ag2O i rzeczywiście nie mówi się o Ag2O jako o tlenku amfoterycznym, bo w jego przypadku silniejszy jest charakter metaliczny pierwiastka i charakter zasadowy bardziej dominuje już nad kwasowym.

Pozostała do wyjaśnienia jeszcze tajemnica metali amfoterycznych. Wrzucając do roztworu mocnej zasady kawałek aluminium, ołowiu czy cynku wydziela się wodór, metal natomiast się roztwarza. Czy jednak rzeczywiście metal reaguje z zasadą, czy też z wodą? Wrzucając kawałek glinu do czystej wody nic się nie dzieje. Jednak jeśli dodać silnej zasady, zaczyna wydzielać się na jego powierzchni wodór. Sumaryczny proces można zapisać tak:
2Al + 2NaOH + 6H2O → Na[Al(OH)4] + 3H2
W równaniu reakcji pojawia się woda. Tajemnica tej reakcji kryje się we właściwościach tlenku i wodorotlenku glinu. Na powietrzu glin jest pokryty warstewką tlenku i wodorotlenku glinu tak szczelną, że metal ten jest praktycznie odporny na korozję. Rzeczywista aktywność glinu jest jednak bardzo wysoka, i gdyby nie warstwa pasywna oddzielająca metal od środowiska, to kontakt glinu z wodą byłby podobny niemal do reakcji sodu z wodą. Jednakże tlenek i wodorotlenek glinu jest amfoteryczny. Roztwarza się w zasadowym środowisku dając gliniany, które są dobrze rozpuszczalne w wodzie. Powoduje to wytrawienie warstewki pasywnej i odsłonięcie gołego metalu. Wtedy glin bez przeszkód może reagować z wodą:
1) wytrawienie warstwy pasywnej: Al(OH)3 + NaOH → Na[Al(OH)4]
2) reakcja odsłoniętego glinu z wodą: 2Al + 6H2O → 2Al(OH)3 + 3H2
3) następcze roztwarzanie wodorotlenku glinu: Al(OH)3 + NaOH → Na[Al(OH)4]
dodając do siebie równania 2 i 3 otrzymamy to samo sumaryczne równanie. Ot, rzekoma amfoteryczność glinu została wyjaśniona. Podobnie będzie się zachowywał cynk, a nawet ołów, gdyż każdy metal o potencjale niższym od potencjału wodoru (w danych warunkach) może go wyprzeć z wody.
Zapraszamy do obejrzenia wideo:
Amfoteryczność a reakcje z wodą amoniakalną
Spotkałem też kolejna trudność związaną z pojęciem amfoteryczności i reakcjami wodorotlenków amfoterycznych z wodą amoniakalną. Prawdą jest, że (CuOH)2 i Zn(OH)2 reagują z wodą amoniakalną. Kłóci się to na pozór z tym co wiemy, że wodorotlenki amfoteryczne reagują z mocnymi zasadami, a amoniak do takich nie należy. Jak więc to jest? Zadając strącony galaretowaty osad Cu(OH)2 stężonym r-rem NaOH lub KOH mozna zaobserować, że roztwór staje się niebieski, wskutek częściowego rozpuszczania tego wodorotlenku. Zadając ten sam osad wodą amoniakalną uzyskamy piękny szafirowy kolor wskutek roztworzenia się osadu. Dlaczego wiec taki słaboamfotetyczny wodorotlenek tak chętnie reaguje ze słabą zasadą?
Jak wiemy, wodorotlenki amfoteryczne reagują z jonami OH– zasady dając aniony kompleksowe, np:
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4]
A w przypadku miedzi:
Cu(OH)2 + 2NaOH → Na2[Cu(OH)4]
Jak widzimy, w pierwszym równaniu powstał cynkan, a w drugim miedzian (II). Co by było, gdyby te osady reagowały z grupami OH powstałymi w wodzie amoniakalnej? Ano musiałby powstać tetrahydroksocynkan amonu (NH4)2[Zn(OH)4] i tetrahydroksomiedzian (II) amonu (NH4)2[Cu(OH)4]. Ale czy na pewno taka reakcja jest możliwa? Wodorotlenek miedzi (II) reaguje z wodnym roztworem NH3, ale nie na zasadzie tworzenia anionu kompleksowego [Cu(OH)4]2-, nie powstanie tetrahydroksymiedzian amonu, jak by to miało miejsce w środowisku silnego wodorotlenku. Amoniak jest słabą zasadą, więc jego odczyn w wodzie nie jest powalająco zasadowy. Natomiast amoniak jako obojętna cząsteczka (podobnie jak i H2O) może tworzyc kompleksy z wieloma metalami, np. Cu2+ da [Cu(NH3)4]2+ z wodą amoniakalną. Natomiast w wodnym roztworze taki jon występuje w postaci słabszego akwakompleksu [Cu(H2O)4]2+, który także jest niebieski. Amoniak tworzy z nim trwalszy kompleks niż woda i wypiera wodę z akwakompleksu.
Reasumując:
W środowisku silnej zasady wodorotlenki amfoteryczne mogą tworzyć aniony, np:
Al(OH)3 + 3NaOH → Na3[Al(OH)6] – heksahydroksyglinian sodu
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4] – tetrahydroksycynkan sodu
I teraz uwaga, bo Zn(OH)2 reaguje także z wodą amoniakalną. NH3 jest słabą zasadą i równowaga reakcji tworzenia NH4+ i OH- jest przesunięta w lewo, a im bardziej stężony roztwór, tym bardziej przesunięta w lewo. Czyli w takiej wodzie amoniakalnej zawierającej 25% NH3, mamy prawie 100% wolnych cząsteczek NH3, a nie jony NH4+. Jon NH4+ nie jest w stanie nic kompleksować (nie posiada już wolnej wolnej pary elektronowej, gdy utworzył wiązanie koordynacyjne z H+, za to OH– jest w stanie, ale jest ich mało bardzo w stosunku do wolnych cząsteczek NH3. Natomiast wprowadzając NaOH czy KOH, to ile wprowadziliśmy moli tych związków, tyle samo wprowadziliśmy OH-, nie ma sytuacji, jak w wodzie amoniakalanej, że ja jeden jon OH– przypadają tysiące wolnych cząsteczek NaOH.
Ok, wracamy do Zn(OH)2:
Zn(OH)2 + 4NH3 → [Zn(NH3)4](OH)2 – wodorotlenek tetraaminacynku. Związek rozpuszczalny w wodzie. Wodorotlenek pozostał wodorotlenkiem, nie utworzył się anion żaden, żadna sól, która byłaby efektem amfoteryczności tego wodorotlenku.
I to samo dzieje się z Cu(OH)2, wodorotlenkiem, który jest słabo amfoteryczny.
W wodzie amoniakalnej rozpuszczają się te wodorotlenki, które tworzą z amoniakiem kompleksy i nie ma znaczenia, czy on jest zasadowy czy amfoteryczny. A czy wiecie, że rzeczywisty wzór pięciowodnego siarczanu miedzi (II) to nie CuSO4*5H2O? Jego rzeczywisty wzór wygląda Cu(H2O)4SO4*H2O – bo jon miedzi występuje w postaci akwakompleksu. Wodę można wymienić na NH3 i otrzymać siarczan tetraaminamiedzi Cu(NH3)4SO4*H2O.
Warto tutaj jeszcze dodać, że Cu(OH)2 tworzy kompleksy z alkoholami di- i polihydroksylowymi. Nie oznacza to jednak, jak się uczy (błędnie) w szkole, że to reakcja potwierdzajaca kwasowość tych alkoholi. Te alkohole też chętnie tworzą z nim kompleksy. Kwasowość alkoholi można by określić po reakcji z odpowiednią zasadą.
A w ogóle gdyby amoniak był silną zasadą, to woda amoniakalna nie śmierdziałaby amoniakiem albo śmierdziała nim słabo. Amoaniak występowałby w wodzie amoniakalnej jako mityczny wodorotlenek amonu i byłby w pełni zdysocjowany, a jony są nielotne, w przeciwieństwie do wolnych cząsteczek. A tymczasem nawet po powąchaniu wilgotnego NH4HCO3 jest odlot, bo to sól trzeźwiąca ze względu na silny zapach amoniaku.
Podsumowując:
1) tworzenie się tlenków i wodorotlenków amfoterycznych nie jest przypadkowe, a ich występowanie jest zjawiskiem powszechnym,
2) nie ma metali amfoterycznych! Tylko tlenki i wodorotlenki.
3) właściwości pierwiastków zmieniają się stopniowo, zachowanie w reakcjach chemicznych jest określone przez to, które właściwości dominują, jeśli nie dominuje żaden charakter, to związek posiada właściwości obu charakterów,
4) wodorotlenki amfoteryczne można traktować jak kwasy tlenowe i w odpowiednich reakcjach zapisywać ich wzór jako kwasu tlenowego, np. H4PbO4 zamiast Pb(OH)4,
5) związki amfoteryczne nazywami amfolitami, ale nie amfoterami, wbrew pierwszym skojarzeniom.
6) wodorotlenki amfoteryczne, podobnie jak inne wodorotlenki, mogą tworzyć kompleksy z obojętnymi ligandami, np. z NH3 i nie ma to związku z ich amfoterycznością.
A jak to będzie z Cr (OH)2 i Cr (OH)3? Według powyższego rozumowania bardziej amfoteryczny jest Cr (OH)2 a Cr (OH)3, jako mający Cr na wyższym stopniu utlenienia, jest kwasowy, jednak odpowiedzi w tekście maturalnym z 2006 roku wskazują inaczej(na odwrót.)
szkoda że nie podałaś dokładnie o który nr zadania chodzi : / według mnie trudno mówić o charakterze Cr na II gdyż jest bardzo nie trwały.
świetny artykuł 🙂 od razu jaśniej w głowie 😀
Dziękuję baaaaaaaaaaaaardzo!!! Od razu jasniej w głowie.