2,4-dinitrofenol – metody preparatywne bez użycia mieszaniny nitrującej
Tytułowy związek jest drogim, ale poszukiwanym odczynnikiem. Poddając go estryfikacji do szczawianu bis(2,4-dinitrofenylu) otrzymujemy bardzo cenny związek i właściwościach chemiluminescencyjnych. Wiele szczawianów difenylowych wykazuje chemiluminescencję i związki te są składnikami chemiluminescencyjnych mieszanek zastrzeżonych przez wiele patentów. Intensywność ich luminescencji podczas utleniania zależy od podstawników obecnych w pierścieniu aromatycznym. Jedno z przejrzanych przeze mnie zgłoszeń patentowy zastrzegało ponad 600 takich szczawianów. Skupię się jednak na jednym z popularniejszych, szczawianie bis(2,4-dinitrofenylu).
Nitrowanie jest bardzo ważną reakcją stosowaną zarówno w przemyśle jak w laboratorium. Klasyczne metody polegają na użyciu mieszaniny nitrującej, to jest mieszaniny kwasów azotowego i siarkowego w różnych proporcjach oraz często z dodatkiem wody. Wszystko zależy od tego, jak łatwo ulega nitrowaniu substancja, którą temu poddajemy. Węglowodory aromatyczne ulegają nitrowaniu wg mechanizmu jonowego, natomiast węglowodory alifatyczne wg mechanizmu rodnikowego, parami kwasu azotowego w wysokiej temperaturze. Jednakże obecność podstawników w pierścieniu aromatycznym zmniejsza lub zwiększa skłonność związku aromatycznego do nitrowania. Podstawniki, które wyciągają elektrony z pierścienia aromatycznego nie sprzyjają nitrowaniu. Jednakże te które dostarczają elektronów do pierścienia silnie zwiększają łatwość nitrowania. Z tego powodu jako odczynnik nitrujący stosuje się różne kombinacje. Dla węglowodorów aromatycznych odpowiednia jest mieszanina nitrująca. Ale dla pochodnych tych węglowodorów z podstawnikami utrudniającymi nitrowanie stosuje się silniejsze mieszanki, zawierające dymiący kwas azotowy (nie mylić ze stężonym, który zawiera 67% HNO3, dymiący zawiera ponad 95% HNO3) i oleum czy nawet wolny N2O5. Natomiast do związków nitrujących się łatwo stosuje się inne czynniki: stężony lub rozcieńczony kwas azotowy, mieszaniny kwasu azotowego z kwasem octowym lub bezwodnikiem octowym, bezwodnik azotowo-octowy (zwany także azotanem acetylu), mieszaniny HNO3 z KHSO4 i inne. Właśnie fenole nitrują się łatwo, dlatego należy podejść do nich racjonalnie. Sam fenol bardzo łatwo ulega dinitrowaniu i trinitrowaniu. Każda dodatkowa grupa nitrowa zmniejsza stabilność pierścienia aromatycznego a 2,4,6-trinitrofenol zwany kwasem pikrynowym jest materiałem wybuchowym i może wybuchnąć będąc w stanie suchym od uderzenia. Dlatego też moc środka nitrującego dobiera się pod kątem kontroli nad reakcją, by uniknąć niebezpieczeństwa. Ponadto kwas azotowy jest utleniający, przez co wiele związków zamiast ulec nitrowaniu w pierścieniu, ulegają utlenieniu grupy funkcyjne. Nitrowanie też jest reakcją redoks, stopień utlenienia azotu zmienia się z V na III, natomiast atomu węgla w pierścieniu aromatycznym z -I na I. Nitrowanie jest też reakcją nieodwracalną, co oznacza, że nie można związków nitrowych shydrolizować z powrotem do wyjściowych związków. Nitrowanie wymaga kwasowego środowiska, jednakże tłumaczenie, że kwas siarkowy sprzyja reakcji, gdyż wiąże wodę, jest niewłaściwe, gdyż ze względu na nieodwracalność reakcji nie można sterować jej równowagą przez odprowadzanie powstającej wody, zwłaszcza, że jak wcześniej powiedziałem, niektóre związki można nitrować nawet rozcieńczonym kwasem azotowym. Trzeba też wiedzieć, że grupa nitrowa silnie wyciąga elektrony z pierścienia, dlatego obecność jednej grupy nitrowej utrudnia podstawienie się kolejnej.
Klasyczna metoda otrzymywania 2,4-dinitrofenolu polega na użyciu fenolu oraz rozcieńczonej mieszaniny nitrującej. Kto jednak pracował z mieszaniną nitrującą, ten wie, że to bardzo brudna robota. Problemem jest wydzielanie się dużych ilości brunatnego NO2, a nie każdy amator pracujący w domowych warunkach ma dostęp do wyciągu lub pracy na wolnym powietrzu, ze względu na warunki atmosferyczne itp. Możliwość rozlania mieszaniny nitrującej, lub co gorsza oparzenia się nią nie należy do przyjemnych. Na nasze szczęście metod nitrowania jest wiele, więc postanowiłem zrobić mały przegląd, chcąc ułatwić życie tym, którzy być może chcą otrzymać ten związek, ale mają ograniczone możliwości sprzętowe.
W ostatnich latach opracowano metody z użyciem krzemionek, tj. bezpostaciowych form dwutlenku krzemu. Właściwie krzemionki takie można traktować jako polikwas krzemowy, gdyż zawierają też różne ilości grup OH. Mają one strukturę mikroporowatą, a co za tym idzie dużą powierzchnię, są też więc dobrymi sorbentami. Obecność grup OH świadczy o ich kwasowym charakterze. Ponadto grupy te można poddać reakcjom, np. wprowadzając reszty kwasu siarkowego, co zwiększa kwasowość tej krzemionki. Oprócz krzemionek używa się też różnych glinek naturalnych o kwasowym charakterze, często wprowadzając do nich inne grupy zwiększające kwasowość. Jednakże ze względu na ich duże użycie i trudniejsze zdobycie skupiłem się na jeszcze innych metodach.
Jak wspomniałem, reakcja wymaga kwaśnego środowiska. Jednakże związki które nitrują się bardzo łatwo nie wymagają silnie kwasowego środowiska. Gdybyśmy próbowali wykonać nitrowanie za pomocą soli kwasu azotowego, np. KNO3 czy NaNO3, to reakcja nie zajdzie, nawet jeśli związek chętnie ulega nitrowaniu. Potrzebny jest jeszcze katalizator, który umożliwi powstanie choćby minimalnych ilości jonu nitroniowego NO2(+), który to jest aktywnym czynnikiem reagującym z pierścieniem aromatycznym. Jeśli dodać KHSO4 jako kwasu, to przeprowadzenie reakcji jest możliwe. Ale czy to konieczne? Jak pisałem już w artykule o tajemnicy amfoteryczności, posuwając się na prawo w układzie okresowym rosną właściwości kwasowe, ze wzrostem stopnia utlenienia także. Zatem stosując sól kwasu azotowego z pierwiastkiem o słabszych właściwościach zasadowych, można by wymusić reakcję nitrowania. Prace naukowe potwierdzają tę tezę.
UWAGA: PRZED PRZYSTĄPIENIEM DO PRAC PREPARATYWNYCH OPISANYCH PONIŻEJ NALEŻY UWZGLĘDNIĆ, ŻE NITROWANIE JEST REAKCJĄ EGZOTERMICZNĄ! PODANE W TABELACH WYNIKI ODNOSZĄ SIĘ DO MAŁEJ SKALI EKSPERYMENTU, DLATEGO WSZELAKIE PRÓBY NALEŻY WYKONAĆ NAJPIERW W MAŁEJ SKALI.
1) Nitrowanie fenoli za pomocą azotanu żelaza (III) oraz azotanu bizmutu (III)
Żelazo na +III stopniu utlenienia jest już znacznie silniej kwasowe niż np. sód czy potas. Tak samo bizmut będący w grupie wraz z azotem. Stąd też związki te zostały zbadane jako czynniki nitrujące. Autorzy pracy numer 1. ucierali lub rozpuszczali w acetonie fenol z solami kwasu azotowego otrzymując następujące wyniki:
| Czynnik nitrujący | Warunki reakcji | Wydajność o-nitrofenolu | Wydajnośćp-nitrofenolu |
| Bi(NO3)3*5H2O | Ucieranie, 5 min | 34% | 37% |
| Bi(NO3)3*5H2O | W acetonie, 5 min | 46% | 47% |
| Fe(NO3)3*9H2O | Ucieranie, 5 min | 29% | 31% |
| AgNO3 | Ucieranie, 10 min | – | – |
| Ni(NO3)2*9H2O | Ucieranie, 10 min | – | – |
| KNO3 | Ucieranie, 10 min | – | – |
| Ca(NO3)3*4H2O | Ucieranie, 10 min | – | – |
| Ba(NO3)2 | Ucieranie, 10 min | – | – |
| Cu(NO3)3*3H2O | Ucieranie, 10 min | – | – |
Jak widać tylko sole z kationem o większej kwasowości chętnie ulegają reakcji nitrowania.
Metoda ucierania fenoli z solą: fenol oraz sól odważa się w stosunku molowym 1:1 i rozciera w moździerzu przez 5 min. Następnie zawartość moździerza zalewa się chlorkiem metylenu, odsącza, i odpędza rozpuszczalnik. W przypadku fenolu otrzymuje się mieszaninę o- i p- nitrofenolu w stosunku 1:1,1 obok nieprzereagowanego fenolu. Produkty można oczyścić przez krystalizację.Używając innych fenoli w ilości 1 milimola oraz 10 milimoli autorzy pracy nr. 1 w odnośnikach otrzymali następujące wyniki:

Metoda z użyciem rozpuszczalnika: takie same ilości substratów rozpuszcza się w acetonie i miesza przez przez czas określony w tabeli na mieszadle magnetycznym lub przez wstrząsanie. Strąca się osad a całość przyjmuje kolor żółty lub pomarańczowy. Osad się odsącza najlepiej pod próżnią, przemywa acetonem lub chlorkiem metylenu, odpędza rozpuszczalniki o oczyszcza przez krystalizację. Autorzy otrzymali następujące wyniki:

2) Nitrowanie fenoli za pomocą azotanu cyrkonylu
Związki cyrkonu na +IV stopniu utleniania także wykazują znacznie już silniejszą kwasowość niż metale pierwszej i drugiej grupy. autorzy publikacji podanej w odnościkach pod numerem 2. użyli dostępnego azotanu cyrkonylu o wzorze. ZrO(NO3)2 * xH2O. Stopień uwodnienia tego związku bywa zmienny. Ma on natomiast tę zaletę, że podobnie jak azotan bizmutu czy żelaza, jest dobrze rozpuszczalny w acetonie (gdyż nie do końca jest prawdą to, co uczą w szkołach, że wszystkie sole mają budowę jonową). Autorzy tej pracy sporządzali roztwory 1 milimola fenolu w acetonie i dodawali równomolową ilość azotanu cyrkonylu. Czas prowadzenia reakcji jest podany w tabeli z wynikami. Po zakończeniu reakcji odpędzali rozpuszczalnik, zadawali stałą masę wodą i ekstrahowali 3 razy octanem etylu. Połączone ekstrakty odparowano i surowy produkt można oczyścić przez krystalizację. Ze względu na brak odczynnika pod ręką nie wykonałem na obecną chwilę prób.
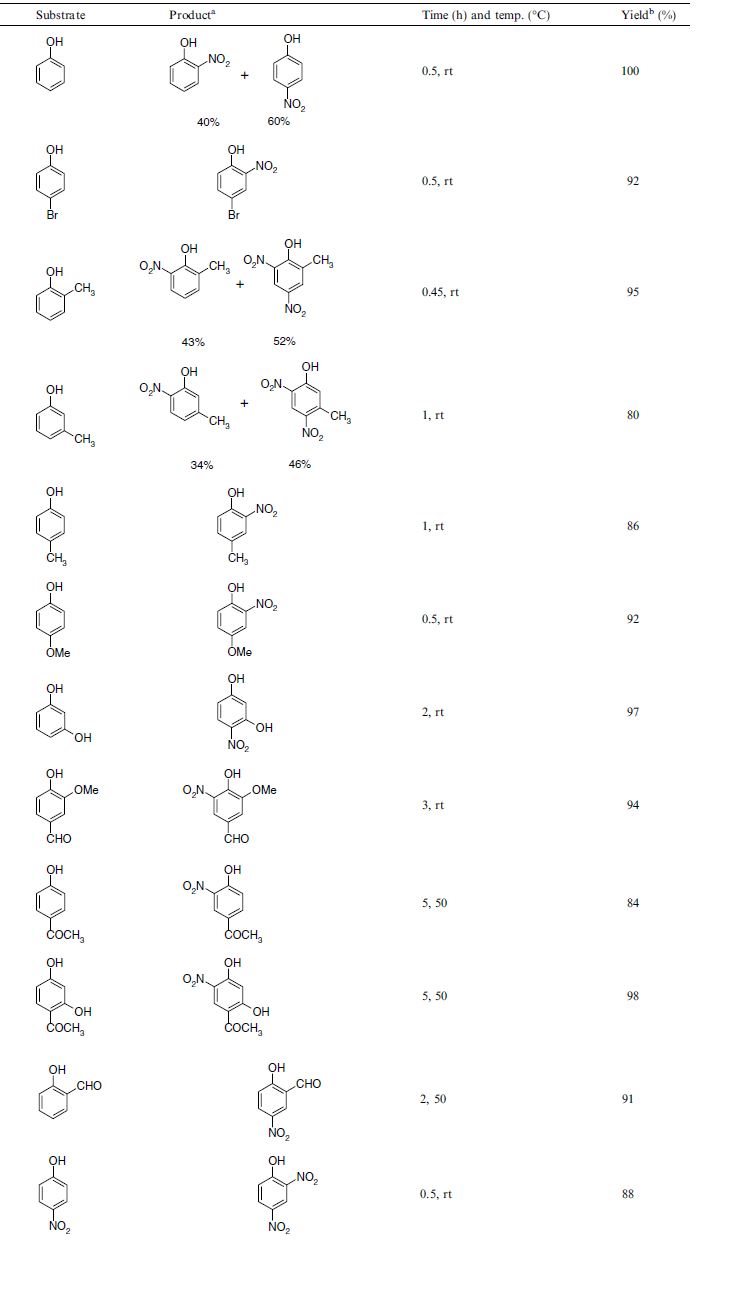
3) Nitrowanie fenoli za pomocą mieszaniny kwasu szczawiowego i azotanu sodu
Kwas szczawiowy w roli katalizatora? A dlaczego nie! Autorzy pracy numer 3. także otrzymali ciekawe wyniki. Jednakże stosowali oni metodę ucierania w moździerzu w warunkach określonych w tabeli poniżej. Po zakończeniu reakcji mieszaninę traktowano chlorkiem metylenu, odsączano i ekstrakt odpędzano. Następnie produkt można oczyścić przez krystalizację.

Z przyczyn czasowych reakcję tę także sprawdzę przy innej okazji i wyniki zamieszczę tutaj.Jednakże planuję reakcję wykonać w rozpuszczalniku, gdyż uzyskanie DNP z fenolu drogą ucierania moze być trudne.
4) 2,4-dinitrofenol z… kwasu salicylowego. Nitrowanie azotanem cerowo-amonowym
Azotan cerowo-amonowy nie jest właściwie solą podwójną, tylko związkiem kompleksowym. Zatem poprawna nazwa brzmi: heksaazotanoceran (IV) amonu, a poprawny wzór to nie (NH4)2Ce(NO3)6, jak dla typowej soli podwójnej, tylko (NH4)2[Ce(NO3)6]. Jest to związek rozpuszczalny w polarnych rozpuszczalnikach organicznych. Autorzy pracy z numerem 4. użyli acetonitrylu jako rozpuszczalnika. ciekawostką jest fakt, że poddając nitrowaniu kwas salicylowy otrzymali 2,4-dinitrofenol, gdyż powstały kwas 3,5-dinitrosalicylowy ulega bardzo łatwo dekarboksylacji. Natomiast całość otrzymanych wyników ilustruje tabela poniżej.

Czy można otrzymać bezpośrednio 2,4-dinitrofenol z fenolu?
Spójrzmy na wyniki. Autorzy prac 1, 2, 3 poddawali nitrowaniu zarówno sam fenol jak p-nitrofenol. A zatem, czy wychodząc z fenolu można by uzyskać od razu 2,4-dinitrofenol? Jak widzimy na podstawie badań, pierwsze podstawienie zachodzi bardzo łatwo. Natomiast drugie w tych samych warunkach jest już znacznie wolniejszym procesem. Gdyby fenol mieszać przez 6 godzin z azotanem bizmutu, to powinniśmy otrzymać głównie dinitrofenol. Zabrałem się więc do pracy, by to sprawdzić.
Odważyłem 2,35 g (0,025 mol) fenolu oraz 12,27 g (0,025 mol) uwodnionego azotanu bizmutu (III). Już podczas dodawania składników do kolbki stożkowej fenol zaczął ciemnieć w kontakcie z solą. Następnie dodałem 25 ml acetonu, wrzuciłem mieszadełko magnetyczne i postawiłem na blacie mieszadła. Osad zaczął się pojawiać niemal natychmiast a mieszanina zmieniać barwę na żółtą (żółta barwa jest bardzo charakterystyczna dla związków nitrowych). Po kilkunastu minutach temperatura przekroczyła 30 stopni Celsjusza, ale potem znowu spadła. Po 3 godzinach wykonałem analizę metodą chromatografii cienkowarstwowej, wg której w mieszaninie nadal znajdował się nieprzereagowany fenol, o- i p-nitrofenol oraz upragniony 2,4-dinitrofenol. Zatem metoda może być użyteczna. Jednakże po 5 godzinach mieszania nadal widac pozostałości fenolu, mononitrofenole i nieco większą plamkę 2,4-dinitrofenolu. W końcu postępując zgodnie z opisem autorów powinienem użyć 2 razy większej ilości soli. Ale uwaga! Ze względu na zatrwarzającą cenę tej soli w POChu nie polecam użycia azotanu bizmutu tamtejszej marki, chyba, że mamy tańsze źródła odczynników! Ja sobie pozwoliłem dysponując starszym odczynnikiem. Ja dodatkowo skupię się na opracowaniu metody z tańszym azotanem żelaza.
ARTYKUŁ TEN BĘDZIE NA BIEŻĄCO UZUPEŁNIANY O WŁASNE OPRACOWANIA PREPARATYWNE!
I jeszcze pytanie, czy domyślacie się, dlaczego nie wszystkie sole z tabelki numer 1 znitrowały fenol?
Literatura:
1) “Highly Efficient Nitration of Phenolic Compounds in Solid Phase or Solution Using Bi(NO3)3â5H2O as Nitrating Reagent”; Hong-Bin Sun, Ruimao Hua and Yingwu Yin; J. Org. Chem. 2005, 70, 9071-9073
2) “Highly efficient nitration of phenolic compounds by zirconyl nitrate”; J. Jon Paul Selvam, V. Suresh, K. Rajesh, S. Ravinder Reddy, Y. Venkateswarlu; Tetrahedron Letters 47, (2006), 2507–2509
3) “Facile and Efficient Selective Mono-nitration of Phenols under Solvent-free Conditions”; S. Beheshti, E. Kianmehr, M. Yahyaee, K. Tabatabai”; Bull. Korean Chem. Soc. 2006, Vol. 27, No. 7, 1056-1058
4) “Nitrophenol Derivatives Oxidized by Cerium(IV) Ammonium Nitrate (CAN) and their Cytotoxicity”; Wen-Bin Pan, Li-Mei Wei, Li-Lan Wei,
Chin-Chung Wu, Fang-Rong Chang and Yang-Chang Wu; Journal of the Chinese Chemical Society, 2005, 52, 581-588