Trick z twierdzeniem Talesa w mieszaninach
Wielu z nas męczyło się z zadaniami z chemii fizycznej i jej podobnymi. Też należałem do tych „wielu”. Jednakże obserwując kiedyś pewne zadanie z chemii fizycznej liczone przez koleżankę na tablicy, która biedaczka sporo się namachała kredą, natrafiłem na pewną matematyczną zależność, która bardzo upraszcza i przyśpiesza obliczenia, do których używamy zwykle wielu praw, np. gazowych. Przede wszystkim sztuczka ta ma dość szerokie zastosowanie w zadaniach z mieszaninami, i przy wyznaczaniu składu mieszaniny, i przy wyznaczaniu składu stanu równowagi. Metoda ta bardzo ułatwiła mi obliczenia w latach studiów podczas liczenia zadań z chemi fizycznej. No ale do rzeczy. Weżmy pod uwagę takie zadanie:
10,00 g stopu glinu i magnezu poddano reakcji:
2Al + 6HCl → 2AlCl3 + 3H2
Mg + 2HCl → MgCl2 + H2
Wydzielony podczas reakcji wodór zajął objętość 11,85 dm3 (w przeliczeniu na warunki normalne). Oblicz skład tego stopu w procentach masowych.
Tradycyjnie układa się w takich przypadkach układ równań, przynajmniej w szkole.
2Al + 6HCl 2AlCl3 + 3H2
54u ——————– 67,2dm3
x ————————- y
Mg + 2HCl MgCl2 + H2
24u ——————– 22,4dm3
10,00g – x —————– 11,85 – y
x = 54y/67,2
10,00-x = [24(11,85-y)]/22,4
I po rozwiązaniu tego układu równań otrzymujemy, że y=8,1 g, czyli stop zawiera 81% glinu i 19% magnezu.
A czy można inaczej dojść do składu tego stopu? Można. Zauważmy, że objętość wydzielonego wodoru ze stopu jest wartością pośrednią pomiędzy objętością wydzieloną z reakcji 10,00 g Mg a 10,00 g Al. Sprawdźmy:
2Al + 6HCl → 2AlCl3 + 3H2
Zakładamy masy molowe pierwiastków 27 g/mol dla glinu i 24 g/mol dla magnezu. A zatem:
n=m/M=10/27=0,3704 mol
A z równania reakcji widać, że to odpowiada 1,5-krotnie większej ilości wodoru: 1,5*0,3704=0,5556 mol, czyli 12,4444 dm3 w przeliczeniu na warunki normalne.
A teraz rozpracujemy magnez:
Mg + 2HCl → MgCl2 + H2
n=10/24=0,4167 mol
ponieważ stechiometria wynosi 1:1, to ilość wydzielonego wodoru wynosi tyle samo moli, czyli po przeliczeniu na objętość 9,3333 dm3.
A zatem widać, że ilość wydzielona ze stopu, jest rzeczywiście pośrednia pomiędzy czystymi pierwiastkami.
A jakby to wyglądało na wykresie? Pozwoliłem sobie narysować wykres:
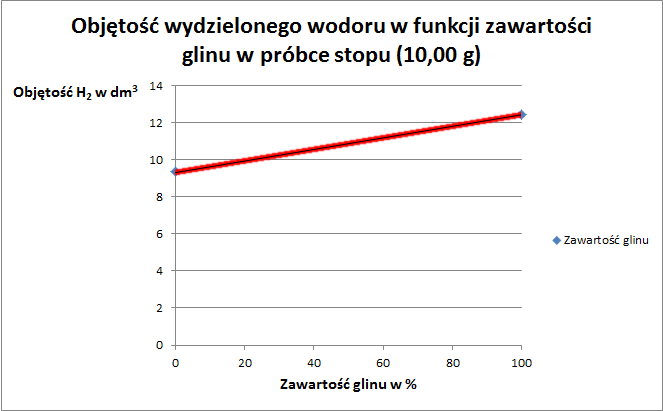
No i teraz się spodziewam, że część osób może być zaskoczona jego wyglądem, że to jest linia prosta. A czy na pewno wychodzi prosta? No to zrobiłem taką tabelkę:

A tak to wygląda na wykresie:

A co ma do tego Tales i jego słynne twierdzenie? To zobaczmy na rysunek poniżej:

Z twierdzenia tego można wyciągnąć następujące zależności:
AB/BD=AC/CE
długość odcinka AB jest niczym innym jak zawartością glinu, długość odcinka BD to innego jak różnicą pomiędzy objętością wodoru wydzieloną ze stopu a objętością wydzieloną z czystego magnezu. W naszym przypadku otrzymujemy różnicę: 11,85-9,33=2,52 a CE to nic innego jak różnica objętości wydzielonego wodoru pomiędzy równymi masami (10 g) glinu i magnezu, czyli 12,44-9,33=3,11. Szukamy długości odcinka AB, czyli x:
x/2,52=100%/3,11
x=81%
Czyli tyle samo co z układu równań. Zauważmy też, że stosunek 2,52/3,11 to 0,81, czyli 81%.
Aktualizacja 29.09.14
A teraz zadanko wygrzebane na zaprzyjaźnionym forum: oblicz, w jakim stosunku objętościowym zmieszano tlen i tlenek węgla (II), jeżeli 20,16 dm3 tej mieszaniny ma masę 25,8 g (objętości gazów odmierzono w warunkach normalnych).
Najpierw obliczymy masę mola tej mieszaniny z prawa Avogadro:
25,8 → 20,16 dm3
x → 22,4 dm3
x=28,67 g
masy molowe czystego tlenu to 32 g/mol a czystego CO to 28 g/mol. Zatem teraz bez zabawy w rysowanie wykresów układam sobie proporcję z twierdzenia Talesa:
100% O2 → 4 g/mol
x → 0,67 g/mol
x=16,67%
co daje stosunek 16,67 : 83,33 = 1 : 5 i tyle samo otrzymamy układając układ równań.
CDN 🙂
Aktualizacja 30.09.14
Na roztworzenie 4g stopu Al z Fe zużyto 22,1g stężonego HCl (36%). Oblicz skład procentowy mieszaniny.
Najpierw obliczmy masę zużytego chlorowodoru: 22,1*36%=7,956 g
wiemy, że podczas roztwarzania zachodzą reakcje:
2Al + 6HCl → 2AlCl3 + 3H2
Fe + 2HCl → FeCl2 + H2
obstawiamy, że mamy po 4 g czystego metalu:
Al:
2*27 g Al → 6*36,5 g HCl
4 → x
x = 16,222 g
Fe:
56 g Fe → 2*71 g HCl
4 → x
x= 5,074 g HCl
różnica mas wynosi dla 100% Al 16,222 – 5,074 = 11,148 g
a nasz stop dał różnicę 7,956 – 5,074 = 1,882 g
no to z twierdzenia Talesa:
100% Al → 11,148
x → 1,882
x=16,9% Al i reszta Fe.
Zauważmy, że stosunek 1,882/11,148 to też zawartość Al.
Aktualizacja 01.10.14
Jeżeli z 16 dm3 stechiometrycznej mieszaniny N2 + 3H2 otrzymujemy 10 dm3 równowagowej mieszaniny gazów, to wydajność reakcji tworzenia amoniaku wynosi:
A. 62,5%
B. 72%
C. 75%
D. 90%
Zaczniemy od równania reakcji:
N2+3H2 → 2NH3
po lewej mamy 4 objętości gazów, a po prawej tylko dwie. zobaczmy na wykres poniżej:
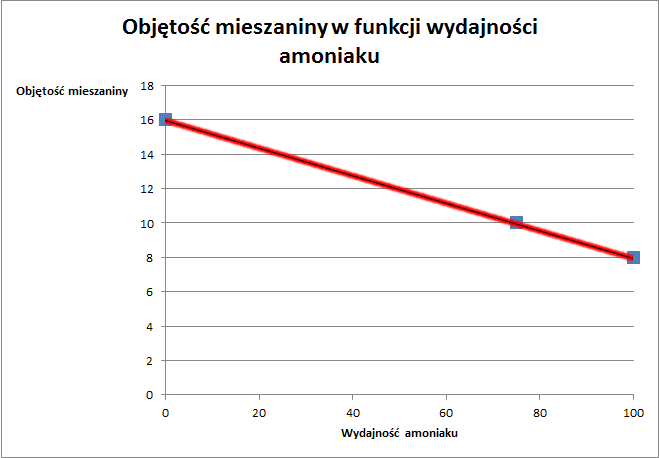
Zatem zgodnie z twierdzeniem Talesa można narysować wykres jak w pierwszym przykładzie i ułożyć taką proporcję:

Z twierdzenia Talesa możemy wyznaczyć kilka równocennych proporcji, niech to będzie:
AE/AB = BE/CD
Albo tak jak jesteśmy bardziej przyzwyczajeni:
AE → AB
BE → CD
A po naszemu:
100% wyd. NH3 → 8 dm3 spadku objętości (bo 16 początkowych minus 8 które zostało po całkowitym przereagowaniu)
x → 6 (bo 16 – 10 pozostałych w stanie równowagi)
x=75%
zauważmy, że tak naprawdę jest to stosunek liczb 6/8.
CDN
Zastanawia mnie, skąd wzięła się tu w przykładzie z 29.09 ta proporcja:
100% O2 –> 4g/mol
x –> 0,67g/mol
A dokładniej skąd to 0,67g/mol? Bo o ile widzę, że te 4g/mol to będzie 32-28, to to 0,67? Nie widzę tego.
Masa molowa mieszaniny 28,67, a 2867-28-0,67 😉