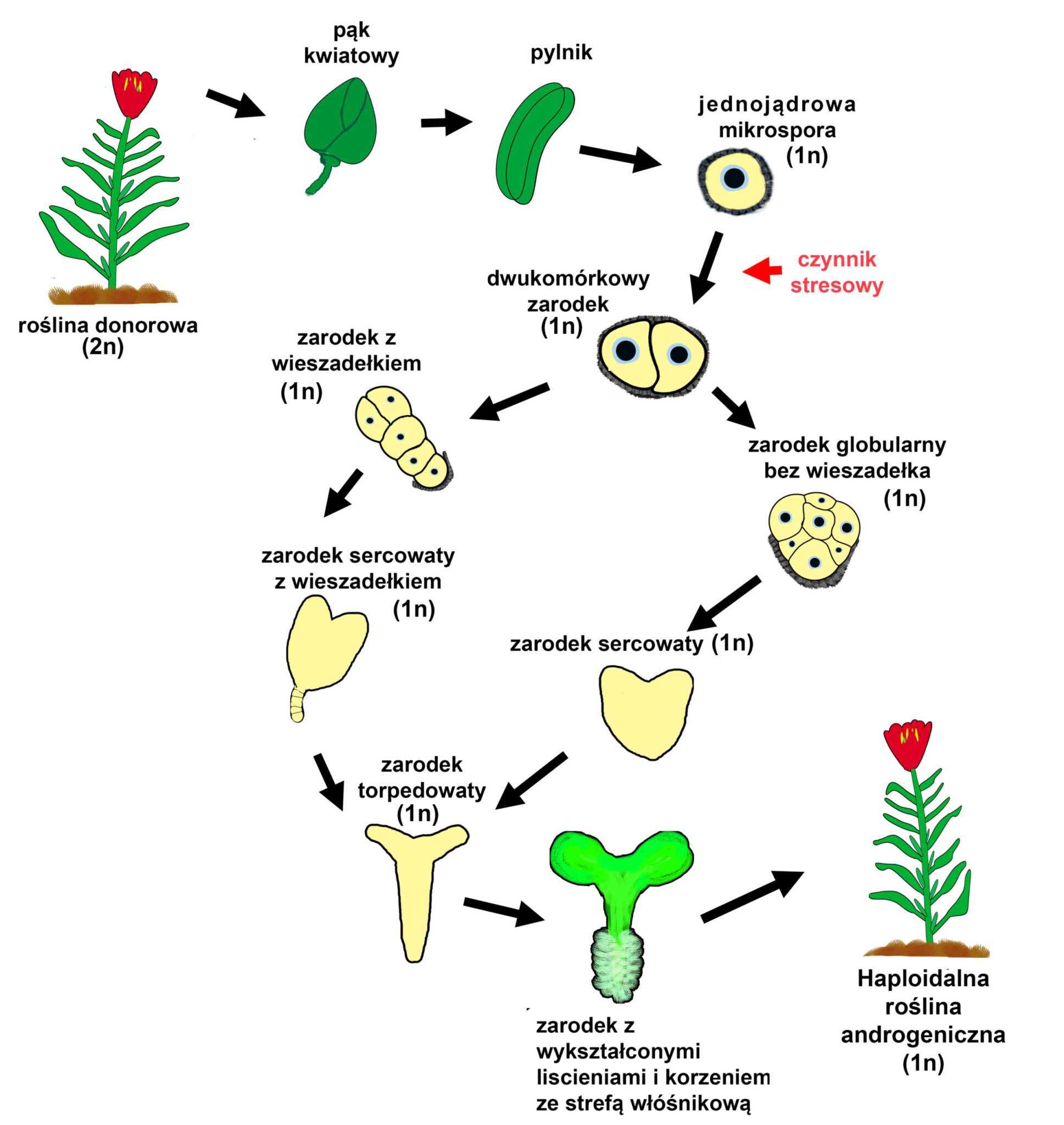
Androgeneza in vitro – sposób na regenerację roślin z pylników lub izolowanych mikrospor
Już na początku lat 60-tych XX wieku dwóch hinduskich badaczy – Guha i Maheshwari prowadząc doświadczenia na młodych pylnikach Datura inoxia wyłożonych na stałą pożywkę obserwowali wzrost zarodków i siewek. Ich doświadczenia zapoczątkowały szereg badań nad indukowaniem rozwoju androgenicznego trwających aż do dziś w wielu ośrodkach badawczych (Rodkiewicz i współautorzy, 1996).
Androgeneza in vitro (z grec. andros – mężczyzna i genesis – pochodzenie) lub inaczej embriogeneza mikrosporowa jest procesem, podczas którego następuje przeprogramowanie rozwoju haploidalnych mikrospor z gametofitowego, prowadzącego do tworzenia funkcjonalnych ziaren pyłku, na sporofitowy, w wyniku którego powstają zarodki, a następnie całe rośliny. Proces ten bazuje na zdolności haploidalnych komórek do odróżnicowania i regeneracji w rośliny, po ekspozycji na czynniki stresowe (Majewska-Sawka, 2012).
1. Czynniki wpływające na indukcję androgenezy oraz jej wydajność
Na indukcję androgenezy i procent zregenerowanych roślin z zarodków mikrosporowych mają wpływ czynniki natury genetycznej, a także warunki fizyczne i chemiczne kultury in vitro. Zaliczyć do nich możemy: gatunek rośliny, genotyp w obrębie gatunku, kondycję rośliny donorowej, fazę rozwojową mikrospor, skład pożywek czy warunki kultury in vitro (Majewska-Sawka, 2012).
1. 1. Gatunek i genotyp rośliny
Jak dotąd, rozwój roślin z mikrospor udało się zainicjować tylko w przypadku niektórych rodzajów czy gatunków roślin, podczas gdy u innych przebieg tego procesu jest nieprawidłowy i często zatrzymuje się na określonych etapach. Zmianę drogi rozwojowej mikrospor i tworzenie zarodków mikrosporowych uzyskano dla ponad 250 roślin, przy czym najlepszą indukcją charakteryzują się rośliny dwuliścienne z rodzaju kapustnych i psiankowatych, jednoliścienne rośliny zbożowe i trawy. Dzięki znacznie szybszemu i bardziej efektywnemu tworzeniu linii haploidalnych i podwojonych haploidów w porównaniu do technik konwencjonalnych, metoda ta znalazła praktyczne zastosowanie w programach hodowlanych rzepaku, pszenicy, jęczmienia, kukurydzy czy ryżu (Majewska-Sawka, 2012).
1. 2. Kondycja rośliny donorowej
Ważnym czynnikiem, który należy brać pod uwagę przed założeniem hodowli, jest kondycja rośliny donorowej. Wyklucza się osobniki zainfekowane przez wirusy, bakterie i grzyby, a także uszkodzone przez szkodniki. W praktyce zazwyczaj wykorzystuje się rośliny hodowane w szklarniach lub fitotronach (czyli uprawianych w warunkach kontrolowanych), co zapewnia stosunkowo dużą jednorodność materiału, a dzięki temu większą powtarzalność badań. Nie bez znaczenia pozostaje także wiek rośliny-dawcy, wykazano bowiem, że najlepszą odpowiedź in vitro uzyskuje się z mikrospor pochodzących z młodych pędów kwiatowych we wczesnej fazie kwitnienia (Majewska-Sawka, 2012).
1. 3. Faza rozwojowa mikrospor
Zmiana drogi rozwoju ściśle zależy od stadium, w którym znajdują się mikrospory. Najbardziej podatne na przeprogramowanie są jednojądrowe, zwakuolizowane mikrospory, natomiast dojrzałe ziarna pyłku okazały się niepodatne na stosowane bodźce (Majewska-Sawka, 2012).
1. 4. Skład pożywek
Bardzo często w celu pobudzenia mikrospor do rozwoju stosuje się modyfikacje w składzie standardowych pożywek zawierających makro- i mikroelementy, witaminy, mioinozytol i sacharozę. Bardzo dobre efekty przynosi zastąpienie sacharozy przez maltozę w kulturach izolowanych mikrospor pszenicy, jęczmienia, żyta i ziemniaka. Dodatkowo pożywki uzupełnia się aminokwasami (głównie cysteiną, proliną, seryną, glutaminą) oraz regulatorami wzrostu z grupy auksyn i cytokinin (Majewska-Sawka, 2012).
1. 5. Czynniki stresowe
Jak pokazują badania, aby zmienić drogę rozwoju mikrospor niezbędne jest zastosowanie jednego lub kilku czynników stresowych. Bardzo często jeszcze przed rozpoczęciem hodowli in vitro stosuje się chłodzenie roślin donorowych, co prawdopodobnie spowalnia procesy degeneracyjne w tkankach pylników i chroni mikrospory przed toksycznymi substancjami uwalnianymi z zamierających pylników. Wykazano także, że umiarkowany szok temperaturowy 32°C przez 1-3 dni, a następnie przeniesienie kultur do 25°C promuje rozwój sporofitowy izolowanych mikrospor rzepaku. Poza tym, wśród gatunków, które pozytywnie reagują na stres temperaturowy, wyróżnić można pszenicę, tytoń, bakłażan, tymotkę czy owies (Shariatpanahi i współautorzy, 2006 i literatura tam cytowana).
Kolejnym czynnikiem wpływającym na embriogenezę mikrosporową jest głód węglowodanowy – mikrospory umieszcza się w pożywkach zawierających zbyt mało przyswajalnych cukrów lub zastępuje się sacharozę mannitolem, który zapewnia właściwe ciśnienie osmotyczne, ale nie jest metabolizowany przez komórki. „Głodzenie” prowadzi do zmian w strukturze chromatyny, zaniku porów w otoczce jądrowej, odróżnicowania plastydów, zmniejszenia objętości jąderka i obniżenia poziomu syntezy RNA, a także syntezy białek szoku cieplnego (HSP, ang. heat shock proteins) (Touraev i współautorzy, 1997).
Jeśli chodzi o czynniki chemiczne, to najpowszechniej stosowaną substancją jest kolchicyna – organiczny związek z grupy alkaloidów o silnie toksycznym działaniu, otrzymywany z nasion zimowita jesiennego (Colchicium autumnale) (Majewska-Sawka, 2012). Kolchicyna powoduje depolimeryzację mikrotubul, czego następstwem jest kilka ważnych zmian w strukturze komórek. Przyściennie ułożone jądro zajmuje pozycję centralną, czego skutkiem jest utrata asymetrii mikrospory (co uważane jest za jeden z pierwszych przejawów zmiany drogi rozwojowej w kierunku embriogenezy). Poprzez dezorganizację mikrotubul niemożliwe staje się prawidłowe funkcjonowanie wrzeciona podziałowego i segregacja chromosomów, w wyniku czego powstają komórki o zduplikowanym garniturze chromosomowym nazywane podwojonymi haploidami. W mniejszym stopniu aplikowane są takie substancje jak kwas abscysynowy, jasmonowy i salicylowy, etanol oraz czynniki feminizujące. Ponadto stosuje się promieniowanie γ, redukcję ciśnienia atmosferycznego i stres suszy. Jako czynnik stresowy uznaje się także wirowanie zawiesiny mikrospor przy 1000 rpm przez kilka minut (Ahmadi i współautorzy, 2014; Hoseini i współautorzy, 2014).
2. Jak zakładamy kultury androgeniczne?
Aby założyć androgeniczne kultury należy zebrać pąki kwiatowe, w których znajdują się pylniki zawierające mikrospory w odpowiednim stadium. Następnie, pąki poddaje się powierzchniowej sterylizacji. Pozostałe czynności przeprowadzane są już w jałowych warunkach, w komorze laminarnej. W przypadku kultur pylników, izoluje się je mechanicznie z pąków i wykłada na stałą pożywkę. Możemy również z pylników wyizolować mikrospory, które po zawieszeniu w porcji płynnej pożywki tworzą kultury zawiesinowe. W trakcie trwania obu wariantów kultur, wraz z upływem czasu zarodki mikrosporowe przechodzą kolejne stadia rozwoju (Pechan i Keller 1988).
3. Stadia rozwoju androgenicznych zarodków
Po izolacji mikrospor i zastosowaniu odpowiedniego czynnika indukującego androgenezę w mikrosporach, już po 24 godzinach, można zauważyć szereg zmian świadczących o sukcesie indukcji. Najbardziej widocznymi zmianami jest powiększenie objętości mikrospory, przesunięcie jądra w pozycję centralną oraz akumulacja ziaren skrobi (Dubas i współautorzy, 2010).
Kolejnym etapem, dzięki któremu możemy potwierdzić przejście mikrospory z gametofitowej na sporofitową drogę rozwoju, jest jej symetryczny podział. W normalnym rozwoju ziarna pyłku (rozwoju gametofitowym), pierwszy podział mitotyczny mikrospory jest asymetryczny i powoduje powstanie dwóch komórek: wegetatywnej i generatywnej (Rodkiewicz, 1996). W androgenezie, po symetrycznym podziale mikrospory zaindukowanym czynnikiem stresowym obie komórki mają podobną organizację. W dalszych podziałach takich komórek zazwyczaj obserwuje się powstanie zarodka w stadium globularnym bez rozwoju struktury podobnej do wieszadełka (suspensora), które pełni ważną rolę w normalnym rozwoju zygotycznego zarodka (Dubas i współautorzy, 2010). W ostatnich latach opracowano metodę pozwalającą otrzymywać androgeniczne zarodki u których z wysoką frekwencją wykształcają się struktury podobne do suspensora (Prem i współautorzy, 2012). Także wczesne pęknięcie egzyny mikrospory zwiększa szansę na pojawienie się tej struktury (Tang i współautorzy, 2013).
Rozwój zarodka androgenicznego, który posiada wieszadełko jest morfologicznie bardzo zbliżony do rozwoju zarodka zygotycznego. Z prazarodka składającego się początkowo z dwóch komórek, po serii podziałów rozwija się zarodek globularny kształtem zbliżony do kuli. Nierównomierne tempo podziałów komórkowych w obrębie różnych stref takiego zarodka powoduje jego spłaszczenie i przyjęcie sercowatego kształtu. W szczytowej części zarodka rozwijają się liścienie, które silnie się wydłużając powodują zmianę kształtu zarodka na torpedowaty. Podobnie jak w embriogenezie zygotycznej, w zarodku androgenicznym, zagłębieniu między liścieniami, powstaje zaczątek wierzchołka pędu, natomiast po przeciwnej stronie formuje się wierzchołek korzenia. Nie obserwuje się dojrzałego stadium liścieniowego (w kształcie litery U), gdyż zarodek androgeniczny nie jest otoczony okrywą nasienną. Dalszy rozwój zarodka (bez stadium spoczynku – cecha charakterystyczna nasion zygotycznych) prowadzi do powstania młodej rośliny, u której wykształcają się liście i korzenie (Tykarska, 1976). Zarodki androgeniczne mogą myć również przechowywane po wysuszeniu i służyć do tworzenia sztucznych nasion (Kruczkowska i współautorzy, 1998).
4. Literatura:
Ahmadi B, Shariatpanahi ME, Teixeira da Silva JA (2014) Efficient induction of microspore embryogenesis using abscisid acid, jasmonic acid and salicylic acid in Brassica napus L. Plant Cell Tissue and Organ Culture 116(3): 343-351
Dubas E, Wedzony M, Petrovska B, Salaj J, Zur I (2010). Cell structural reorganization during induction of androgenesis in isolated microspore cultures of triticale (xTriticosecale wittm.). Acta Biologica Cracoviensia Series Botanica 52(1): 73-86
Hoseini M, Ghadimzadeh M, Ahmdi B, Teixeira da Silva JA (2014) Effects of ascorbic acid, alpha-tocopherol and glutathione on microspore embryogenesis in Brassica napus L. In vitro Cellular and Developmental Biology – Plant 50(1): 26-35
Kruczkowska H, Pawłowska H, Skucińska B (1998) Haploidyzacja rzepaku: badania podstawowe i zastosowania. Rośliny Oleiste XIX: 343-351
Majewska-Sawka A (2012) Otrzymywanie haploidów. W: Malepszy S (red.) Biotechnologia roślin. Wydawnictwo Naukowe PWN, Warszawa, s. 87-99
Prem D, Solis MT, Barany I, Rodriguez-Sanz H, Risueno M, Tesrillano P (2012) A new microspore embryogenesis system under low temperature which mimics zygotic embryogenesis initials, expresses auxin and efficiently regenerates doubled-haploid plants in Brassica napus. Plant Biology 12:127
Pechan PM, Keller WA (1988) Identification of potentially embryogenic microspores in Brassica napus. Physiologia Plantarum 74: 377–384
Rodkiewicz B, Śnieżko R, Fryk B, Niewęgłowska B, Tchórzewska D (1996) Embriologia Angiospermae rozwojowa i eksperymentalna, Wydawnictwo UMCS, Lublin
Rodkiewicz i współaut. Embriologia Angiospermae rozwojowa i eksperymentalna (1996). Wydawnictwo Uniwersytetu Marii Curie – Skłodowskiej, Lublin
Shariatpanahi ME, Bal E, Heberle-Bors E, Touraev A (2006) Stresses applied for the re-programming of plant microspore towards in vitro embryogenesis. Physiologia Plantarum 127: 519-534
Tang X, Liu Y, He Y, Ma L, Sun MX (2013) Exine dehiscing induces rape microspore polarity, which results in different daughter cell fate and fixes the apicalbasal axis of the embryo. Journal of Experimental Botany 64(1): 215-228
Touraev A, Vincente O, Heberle-Bors E (1997) Initation of microspore embryogenesis by stress. Trends in Plant Science 2: 297-302
Tykarska T (1976) Rape embryogenesis I: The proembryo development. Acta Societatis Botanicorum Poloniae 4: 3-16
Autorzy artykułu:
Agata Wilk, Artur Wydra, Małgorzata Kapusta, Joanna Rojek
Uniwersytet Gdański, Wydział Biologii, Katedra Cytologii i Embriologii Roślin