Cykl Crebsa
CYKL CREBSA
Cykl Crebsa, znany również jako cykl kwasu cytrynowego, czy cykl kwasów trikarboksylowych, to cykliczny szereg reakcji biochemicznych, stanowiący końcowy etap utleniania cząsteczek będących źródłem energii dla organizmów oddychajacych tlenem, czyli aerobów. Mechanizm tego cyklu zbadał w latach 30. XX wieku sir Hans Krebs, biochemik i lekarz niemiecki pochodzenia żydowskiego. Kluczowe etapy cyklu przedstawił w 1937 roku, za co dostał w 1953 nagrodę Nobla.
Cykl Crebsa zachodzi w mitochondriach, a dokładniej: w macierzy mitochondrialnej, czyli „miąższu” mitochondrium. W wyniku tego cyklu freakcji Crebsa wytwarzana jest energia, którą później organizm magazynuje w postaci cząsteczek z wysokoenergetycznymi wiązaniami, poza tym powstają prekursory ważnych biocząsteczek.
Substratem cyklu jest acetylokoenzym A (zapisywany skrótowo: acetylo-CoA, Ac-CoA). Związek ten powstaje ze składników pokarmowych, tj. cukrów, tłuszczów i białek, które wpierw są trawione, ulegając licznym reakcjom, np. cukry ulegają glikolizie, tłuszcze: beta-oksydacji, zaś białka deaminacji i oksydacji. Nie będę prezentować poszczególnych etapów biosyntezy tego związku, wspomnę jedynie, że jedna z dróg tej biosyntezy jest to reakcja reszty kwasu pirogronowego z koenzymem A (Co-A), w której zachodzi jednocześnie dekarboksylacja. Warto natomiast przyjrzeć się strukturze cząsteczki acetylokoenzymu A i spróbować w niej wyróżnić fragmenty stanowiące inne, prostsze, cząsteczki:

Acetylokoenzym A spełnia niezwykle ważną rolę w tym cyklu przekształceń biochemicznych, ponieważ jest „transporterem” grupy acetylowej CH3CO- (zawierającej dwa atomy węgla).
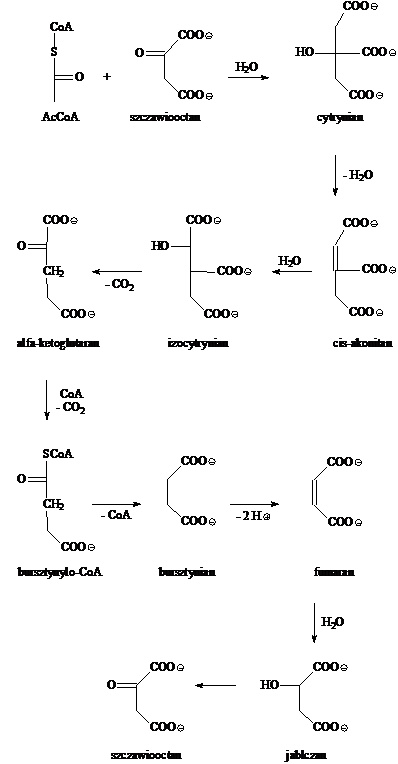
Cykl Crebsa można w uproszczony sposób przedstawić za pomocą poniższego schematu:

Poniżej króciutko przedstawię, co zachodzi w poszczególnych etapach cyklu Crebsa:
Pirogronian —> AcCoA: koenzym A łączy się z resztą kwasu pirogronowego, czyli pirogronianem, zachodzi dekarboksylacja, czyli odłączenie cząsteczki CO2 oraz przyłączenie reszty acetylowej i powstaje acetylokoenzym A.
AcCoA —> cytrynian: acetylo-CoA łączy się ze szczawiooctanem, katalizatorem tej reakcji jest syntaza cytrynianowa. Produktem takiej reakcji jest cytrynylo-CoA, który rozpada się na wolny koenzym A oraz cytrynian, będący związkiem sześciowęglowym.
Cytrynian —> cis akonitan: cytrynian ulega zaraz dehydratacji, czyli odłączeniu cząsteczki wody, reakcję tą katalizuje akonitaza. Powstaje cis-akonitan, związek z wiązaniem podwójnym w cząsteczce.
cis-Akonitan —> izocytrynian: Utworzony w poprzednim etapie związek nienasycony, cis-akonitan, przyłącza cząsteczkę wody, czyli następuje hydratacja, jednakże grupa hydroksylowa przyłącza się nie do trzeciego, a do drugiego atomu węgla. Powstaje zatem związek, w którym grupa –OH znajduje się przy sąsiednim atomie węgla, w porównaniu z cytrynianem.
Izocytrynian —> alfa-ketoglutaran: powstały w poprzednim etapie izocytrynian ulega utlenieniu, a dokładniej: utleniona zostaje grupa hydroksylowa do kabonylowej. Tak powstały związek to szczawioglutaran. Zanim jeszcze odłączy się od enzymu, którym jest dehydrogenaza izocytrynianowa, jako beta-ketokwas, szybko ulega dekarboksylacji. Produktem, oprócz dwutlenku węgla, jest alfa-ketoglutaran. Jest to związek pięciowęglowy.
Alfa-ketoglutaran —> bursztynylo-CoA: alfa-ketoglutaran ulega oksydacyjnej dekarboksylacji, podobnie, jak pirogronian. Katalizatorem jest kompleks dehydrogenazy alfa-ketoglutaranowej. W procesie tym bierze udział pięć kofaktorów, czyli substancji, które są niezbędne enzymom do katalizowania reakcji. Są to: pirofosforan tiaminy, TPP, amid kwasu liponowego, koenzym A, dinukleotyd flawinoadeninowy (FAD) oraz dinukleotyd nikotynoamidoadeninowy, (NAD+). Produktem tej grupy przekształceń jest bursztynylo-koenzym A, związek czterowęglowy.
Bursztynylo-CoA —> bursztynian: powstały w poprzednim etapie bursztynylo-CoA, jako związek posiadający wiązanie wysokoenergetyczne, zostaje wykorzystany do przeprowadzenia fosforylacji substratowej przy użyciu fosforanu nieorganicznego. Katalizujący ten proces enzym nazywany jest syntetazą sukcynylo-CoA albo tiokinazą bursztynianową.
Bursztynian —> fumaran: w powyższej reakcji powstaje wolny koenzym A i bursztynian. Ten ostatni ulega dehydrogenacji, czyli odwodornieniu. Katalizatorem tego procesu jest dehydrogenaza bursztynianowa. Powstaje dikarboksylowy kwas nienasycony z konfiguracją trans, czyli kwas fumarowy, którego anion zwany jest fumaranem.
Fumaran —> jabłczan: do cząsteczki fumaranu przyłącza się cząsteczka wody. Reakcję katalizuje hydrataza fumaranowa. Produktem takiej reakcji jest L-jabłczan. Nadal jest to związek czterowęglowy.
L-jabłczan —> szczawiooctan: w ostatnim etapie cyklu Crebsa dochodzi do utlenienia jabłczanu, co prowadzi do odtworzenia cząsteczki szczawiooctanu, który może reagować z cząsteczką acetylo-koenzymu A i dalej brać udział w omawianym cyklu. Katalizatorem tego etapu jest dehydrogenaza jabłczanowa, jednak reaguje ona tylko z naturalnie występującym izomerem L-jabłczanu, natomiast z izomerem D, otrzymywanym syntetycznie, już nie reaguje.
A oto, jak w uproszczony sposób można przedstawić ciąg przekształceń chemicznych w obrebie cyklu Crebsa:
A teraz garść informacji na temat kwasów karboksylowych biorących udział w cyklu Crebsa:
Kwas pirogronowy:
– nazwa systematyczna: kwas 2-oksopropanowy
– inne nazwy: α-ketopropionic acid; acetylformic acid; pyroracemic acid
– wzór sumaryczny: C3H4O3
– masa cząsteczkowa: 88,06
– temp. top.: 11 – 12 oC
– pKa: 2,49
– pochodzenie nazwy: „piro” + „gronowy” nazwa pochodzi od pierwszego sposobu otrzymania tego kwasu: suchej destylacji winogron
– występowanie: jabłka, sfermentowane owoce
Kwas cytrynowy:
– nazwa systematyczna: kwas 2-hydroksy-1,2,3-propanotrikarboksylowy
– wzór sumaryczny: C6H8O7
– masa cząsteczkowa: 192,12
– temp. top.: 153 oC
– pKa: pKa1 = 3,15; pKa2 = 4,77; pKa3 = 6,40
– pochodzenie nazwy: od cytryny – owocu będącego jednym z pierwotnych źródeł tego związku
– występowanie: w niektórych owocach, np. w cytrynach, w których stanowi nawet do 8 % suchej masy (co odpowiada 0,65 % masy świeżej cytryny)
Kwas cis-akonitowy:
– nazwa systematyczna: kwas prop-1-eno-1,2,3-trikarboksylowy
– inne nazwy: Achilleic acid; Equisetic acid; Citridinic acid; Pyrocitric acid
– wzór sumaryczny: 174.11
– masa cząsteczkowa: C6H6O6
– temp. top.: 122 oC
Kwas izocytrynowy:
– nazwa systematyczna: kwas 1-hydroksypropano-1,2,3-trikarboksylowy
– wzór sumaryczny: C6H8O7
– masa cząsteczkowa: 192.12
– temp. top.: 122 oC
– występowanie: owoce
Kwas alfa-ketoglutarowy:
– nazwa systematyczna: kwas 2-oksopentano-1,5-diowy
– inne nazwy: 2-Ketoglutaric acid; alpha-Ketoglutaric acid; 2-Oxoglutaric acid
– wzór sumaryczny: C5H6O5
– masa cząsteczkowa: 146,11
– temp. top.: 113.5 oC
Kwas bursztynowy:
– nazwa systematyczna: kwas 1,4-butanodiowy
– wzór sumaryczny: C4H6O4
– masa cząsteczkowa: 118,09
– temp. top.: 185 oC
– pochodzenie nazwy: od łacińskiego słowa „succinum”, oznaczającego bursztyn, z którego pozyskiwano kwas bursztynowy na drodze suchej destylacji
– występowanie: w większości owoców i warzyw
Kwas fumarowy:
– nazwa systematyczna: kwas trans-butenodiowy
– wzór sumaryczny: C4H4O4
– masa cząsteczkowa: 116,07
– temp. top.: 302 oC
– pKa: pKa1 = 3,03, pKa2 = 4,44
– pochodzenie nazwy: został po raz pierwszy pozyskany z grzyba o nazwie dymnica (Fumaria officinalis)
– występowanie: w mchach i grzybach
Kwas jabłkowy:
– nazwa systematyczna: kwas hydroksybutanodiowy (występuje w dwóch postaciach izomerycznych)
– wzór sumaryczny: C4H6O5
– masa cząsteczkowa: 134,09
– temp. top.: 100 oC, racemat: 128–130 oC
– pochodzenie nazwy: po raz pierwszy został pozyskany z soku jabłek
– występowanie: kwas L-(-)-jabłkowy (z konfiguracją absolutną S) występuje w niedojrzałych owocach, np. jabłkach, jarzębinie, wiśniach; kwas D-(+)-jabłkowy (z konfiguracją absolutną R) nie występuje w postaci naturalnej, otrzymywany jest jedynie syntetycznie
Kwas szczawiooctowy:
– nazwa systematyczna: kwas ketobutanodiowy
– inne nazwy: oxaloacetic acid, kwas oksalooctowy, Oxosuccinic acid
– inne nazwy: kwas oksalooctowy
– wzór sumaryczny: C43H4O5
– masa cząsteczkowa: 132,072
– temp. top.: 161 oC
genialne 😉