Diagnostyka molekularna w praktyce: metoda Real Time PCR w rozpoznawaniu przyczyn infekcji układu pokarmowego
Przyczyny i konsekwencje infekcji układu pokarmowego
Infekcje przewodu pokarmowego wywołane przez bakterie, wirusy oraz pasożyty odpowiedzialne są za znaczącą we wszystkich grupach wiekowych chorobotwórczość i śmiertelność. W grupie ryzyka zarażeniem znajdują się zarówno dorośli jak i dzieci, przebywający w dużych zbiorowiskach, podróżujący po świecie, przebywający w hotelach o niskim poziomie czystości, obgryzający paznokcie, osoby z niedoborami immunologicznymi, nieprzestrzegające prawidłowej higieny rąk [1]. Brudne dłonie stanowią doskonały środek transportu dla mikroorganizmów oraz jaj pasożytów, które poza ciałem gospodarza są w stanie przetrwać nawet kilka dni. Do czynników sprzyjających zarażeniu należą: przebywanie w miejscach publicznych, jedzenie niemytych owoców, warzyw, surowych ryb, mięsa wieprzowego, picie nieprzegotowanej wody, kąpiele w naturalnych zbiornikach wodnych. Infekcje układu pokarmowego manifestują się szeregiem objawów takich jak biegunka, bóle brzucha, wymioty, gorączka. W przypadku infekcji pasożytniczych objawy mogą być mniej nasilone i o przewlekłym charakterze, przez co często pacjenci je ignorują i nie wiążą z zakażeniem. W większości przypadków objawy zarażenia układu pokarmowego mijają samoistnie po kilku, kilkunastu godzinach, bez większego wpływu na zdrowie chorego. Czasami jednak pozornie nieszkodliwa infekcja pozostawia po sobie długotrwałe i poważne powikłania zdrowotne, a nawet stanowi bezpośrednie zagrożenie życia. Najczęstszą konsekwencją ostrej biegunki i wymiotów jest odwodnienie. Nieuzupełnianie płynów, przy zwiększonej ich utracie, może być przyczyną bezmoczu bezpośrednio powiązanego z zaburzeniami funkcji nerek i zatruciem organizmu. Ponadto długotrwałe odwodnienie organizmu nie pozostaje bez wpływu na komórki układu nerwowego i działanie mózgu. W skrajnych przypadkach odwodnienie dużego stopnia prowadzi do zgonu pacjenta. Niektóre szczepy bakterii, wywołujące zatrucia pokarmowe, mogą powodować tzw. krwotoczne zapalenie jelit oraz toksyczne rozdęcie jelita grubego. Wymienione stany patologiczne mogą być przyczyną niedrożności jelit, prowadzącej do ich martwicy, a w konsekwencji do wycięcia zajętego fragmentu jelita. Infekcje bakteryjne, zwłaszcza u dzieci, mogą być również przyczyną tzw. zespołu hemolityczno-mocznicowego. Jest to choroba wielonarządowa, która może prowadzić do ostrej niewydolności nerek. Bakterie z grupy Campylobacter, są jedną z najczęstszych przyczyn biegunek o etiologii bakteryjnej i mogą być przyczyną choroby neurologicznej – zespołu Guillaina-Barrego. U większości chorych zespół mija bez pozostawienia trwałych następstw, jednak u części pozostają niektóre objawy neurologiczne, a w sporadycznych przypadkach dochodzi do zgonu z powodu niewydolności oddechowej. Szybka i precyzyjna identyfikacja patogenów przewodu pokarmowego jest niezbędna do wdrożenia celowanego i skutecznego leczenia przyczynowego oraz podjęcia właściwej kontroli epidemiologicznej celem ograniczenia lub zapobiegania rozprzestrzenianiu się czynników chorobotwórczych, często odpowiedzialnych za poważne powikłania zdrowotne, a w skrajnych przypadkach nawet za zagrożenie życia pacjenta.
Możliwości i problemy diagnostyczne infekcji układu pokarmowego
Objawy kliniczne infekcji żołądkowo-jelitowych są często podobne, dlatego istotną rolę w identyfikacji czynnika zakażenia odgrywają badania diagnostyczne. Diagnostyka laboratoryjna oferuje zarówno techniki konwencjonalne takie jak badania mikroskopowe, metody hodowlane, serologiczne oraz nowoczesne techniki molekularne. Szereg dostępnych metod laboratoryjnych często wiąże się z ograniczeniami wynikającymi z czułości metody, specyficzności, czasu realizacji oraz kosztów.
Złoty standard w diagnostyce patogenów bakteryjnych wciąż stanowią metody hodowlane. Stosowane podłoża umożliwiają wzrost różnych bakterii i pozwalają jedynie na wstępne ich różnicowanie. Czas inkubacji dla większości bakterii wynosi 18-24 godzin, dla bakterii beztlenowych i grzybów 48 godzin. Dalsza identyfikacja uzyskanych kolonii odbywa się na podstawie aktywności biochemicznej, zdolności do metabolizowania różnych substancji np. węglowodanów lub wytwarzania określonych enzymów np. oksydazy. Klasyczne metody mikrobiologiczne często nie pozwalają na jednoznaczną identyfikację szczepów bakteryjnych z powodu wspólnych cech biochemicznych. Ponadto metoda ta jest czasochłonna, co jest jej największym ograniczeniem w sytuacji natychmiastowej konieczności wdrożenia leczenia. Do identyfikacji bakterii patogennych wykorzystywane są również metody immunologiczne, wykorzystujące reakcję antygenów bakteryjnych ze specyficznymi przeciwciałami oraz spektrometria masowa oparta na analizie białek rybosomalnych. Pomimo otrzymania wiarygodnych wyników spektrometria mas cechuje się bardzo wysokim kosztem badania i brakiem możliwości oznaczenia wrażliwości na antybiotyki [3,4].
W przypadku diagnostyki pasożytów jelitowych wciąż nie został wyznaczony złoty standard, co przekłada się na dużą różnorodność stosowanych technik laboratoryjnych. Stosowane są metody makroskopowe, mikroskopowe, immunologiczne pozwalające na wykrywanie w surowicy swoistych przeciwciał (IgG, IgM, IgA, IgE) lub badania na obecność antygenów pasożytów. Najczęściej wykorzystywanym materiałem biologicznym do identyfikacji pasożytów układu pokarmowego jest kał. W przypadku wykrywania pierwotniaków (Giardia intestinalis, Cryptosporidium spp.) i obleńców (Strongylodes stercoralis) materiał diagnostyczny stanowi również treść dwunastnicy. Pobieranie żółci sondą należy do procedur inwazyjnych i jest obarczone ryzykiem wystąpienia powikłań [2].
W przypadku identyfikacji patogenów wirusowych układu pokarmowego stosowane są metody immunochromatograficzne, pozwalające na wykrywanie antygenów wirusa. Metody serologiczne znajdują zastosowanie w identyfikacji zakażeń rotawirusami, adenowirusami oraz norowirusami.
Przewaga badań molekularnych nad biochemicznymi i mikroskopowymi
Nieocenione w identyfikacji patogenów układu pokarmowego i w postawieniu właściwego rozpoznania są metody molekularne. Są niezastąpione w przypadku, gdy hodowla drobnoustrojów jest niemożliwa, trudna technicznie lub długotrwała. Metody molekularne pozwalają na wykrywanie materiału genetycznego mikroorganizmów, co ma szczególne znaczenie w przypadku identyfikacji wirusów, wolnorosnących bakterii, szczepów bakterii o podobnych cechach biochemicznych, pasożytów czy innych atypowych drobnoustrojów. Klasyczna reakcja PCR pozwala na powielanie unikalnych fragmentów DNA charakterystycznych dla konkretnych patogenów, czyli ich amplifikacji za pomocą enzymu polimerazy. Powielone fragmenty DNA są uwidaczniane za pomocą specjalnych barwników, a następnie analizowane. Metoda Real-Time PCR (PCR w czasie rzeczywistym), stanowiąca modyfikację klasycznej reakcji PCR z zastosowaniem sond fluorescencyjnych, pozwala na wykrywanie produktu amplifikacji już podczas przebiegu reakcji. Metoda umożliwia ocenę liczby kopii patogenów, co pozwala na monitorowanie przebiegu infekcji i skuteczności leczenia pacjenta. Czas wykonania badania jest stosunkowo krótki i wynosi zazwyczaj kilka godzin. W odniesieniu do metod hodowlanych technika Real-Time PCR wykazuje zarówno wyższą czułość oraz swoistość. Gdy w badanej próbce jest niewielkie miano wirusa lub okres jego wydalania jest krótki, wówczas koncentracja wirusa może szybko spadać. W konsekwencji wirus może być niewykrywalny innymi metodami niż Real-Time PCR. Ze względu na wysoką czułość Real-Time PCR, analizę można wykonać już na podstawie niewielkiej ilości pobranego materiału. Rewolucję w diagnostyce laboratoryjnej stanowi multipleksowa reakcja Real-Time PCR identyfikująca materiał genetyczny od kilku do kilkudziesięciu patogenów podczas jednej reakcji. Dzięki temu możliwe jest wykrycie koinfekcji (wykrycie większej liczby sprawczych patogenów) i dobranie właściwego leczenia. W przypadku metod klasycznych wykrycie jednego czynnika patogennego często prowadzi do zaprzestania dalszej diagnostyki, co niekoniecznie prowadzi do wyleczenia infekcji.
Cel badania: Ocena struktury zlecanych badań i zidentyfikowanych patogenów na przykładzie doświadczeń własnych
Metodyka
Materiał do badania stanowiły 184 próbki kału, zawieszone w 1 mL medium transportowego eNAT™ (Copan). Próbki dostarczono do Laboratorium Diagnostyki Molekularnej genXone SA w latach 12.2019-11.2020. Przed etapem rozpoczęcia procedury badawczej materiał biologiczny był przechowywany w temperaturze 4°C. Wszystkie próbki poddano izolacji RNA i DNA w oparciu o metodę kolumienkową z zastosowaniem zestawów odczynników GeneAll® RiboSpin™ vRDII. Etapy przygotowania próbek do izolacji oraz jej przebieg przeprowadzono zgodnie z zaleceniami producenta, stosując protokół dla próbek kału. Amplifikację i wykrywanie sekwencji specyficznych dla wirusów wywołujących infekcje układu pokarmowego przeprowadzono z zastosowaniem jednoetapowej reakcji multipleks Real-Time RT-PCR. Wykrywanie sekwencji wybranych patogenów bakteryjnych i pasożytniczych przeprowadzono z wykorzystaniem techniki multipleks Real-Time PCR (Ryc.1.).
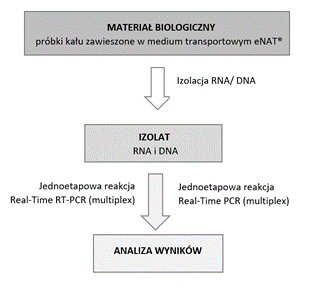
Do etapu amplifikacji zostały zastosowane zestawy odczynnikowe Allplex™ Gastrointestinal Panel Assays (Seegene) oraz Allplex™ GI-Helminth I Assay (Ryc.2.). Skład mieszaniny reakcyjnej oraz profil temperaturowy przebiegu reakcji był zgodny z zaleceniami producenta. Każda reakcja PCR była przeprowadzona równolegle dla próbek badanych oraz kontroli pozytywnej i negatywnej. Przeprowadzone badania miały charakter retrospektywny i nie nosiły cech eksperymentu.

1.1. Struktura terytorialna zleconych badań i uzyskanych wyników pozytywnych.
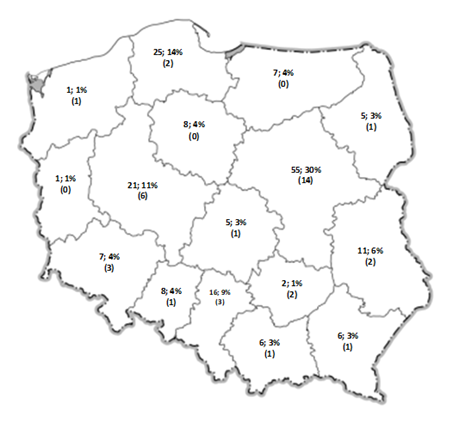
Zlecono łącznie 184 badania w kierunku wykrycia i identyfikacji patogenów odpowiedzialnych za infekcje układu pokarmowego. Zlecenia pochodziły ze wszystkich 16 województw w Polsce, z czego najwięcej z województwa mazowieckiego (55 zleceń), pomorskiego (25) oraz wielkopolskiego (21). Wyniki pozytywne uzyskano u 41 pacjentów z całego kraju. W przypadku podziału na województwa, najwięcej stwierdzono u pacjentów z mazowieckiego (14 wyników pozytywnych), wielkopolskiego (6) oraz lubuskiego (3) (Ryc.3.).
Analiza struktury zleconych badań ze względu na wielkość miejscowości zamieszkania pacjentów, wykazała, że najwięcej zleceń pochodziło z dużych i bardzo dużych miast o liczbie mieszkańców odpowiednio: od 100 do 500 tys.– 52 zlecenia (28% wszystkich zleceń) oraz powyżej 500 tys. – 46 (25%) (Ryc.4.). Najniższą liczbę zleceń odnotowano z miast od 50 do 100 tys. – 11 (6%) oraz do 10 tys. – 4 (2%). W dalszych analizach zawężono podział miejscowości na: duże (>100 tys.), średnie (<100 tys.) oraz małe (<10 tys.). Stosując następujące kryteria podziału 98 (53%) zleceń pochodziło od pacjentów z dużych miejscowości, 47 (26%) zleceń ze średnich oraz 39 (21%) z małych.

1.2. Struktura badanych pacjentów wg płci oraz wieku.
Rozkład płci badanych pacjentów był porównywalny, przebadano 93 (51% wszystkich zleceń) kobiety oraz 91 (49%) mężczyzn (Ryc.5.). W przypadku analizy struktury zleconych badań ze względu na wiek pacjentów wykazano, że prawie 2 razy częściej badania zostały zlecone u osób dorosłych (124 zlecenia) w porównaniu do dzieci (60) (Ryc.6.).


1.3. Struktura badanych pacjentów wg zleconych badań oraz wykrytych patogenów.
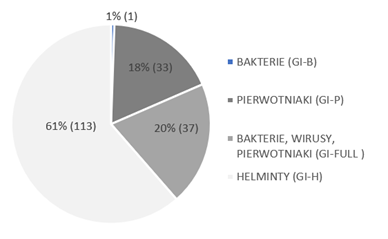
Wśród dostępnych 4 paneli pozwalających na wykrycie materiału genetycznego patogenów stanowiących najczęstszą przyczynę zakażeń układu pokarmowego najczęściej zalecany był panel HELMINTY (płazińce, obleńce, mikrosporydia; GI-H) –113 zleceń (61% zleconych wszystkich paneli). Mniej popularne pod względem zleconych badań były panele diagnostyczne wykrywające jednocześnie BAKTERIE, WIRUSY ORAZ PIERWOTNIAKI (GI-FULL) – 37 zleceń (20%) oraz panel PIERWOTNIAKI (GI-P) 33 zleconych badań (18%). Najrzadziej zlecano panel diagnostyczny BAKTERIE (GI-B) – 1 zlecenie (Ryc.7.).
Łącznie zlecono 184 badania w kierunku wykrycia i identyfikacji patogenów odpowiedzialnych za infekcje układu pokarmowego. W 145 badaniach nie wykryto żadnego z badanych patogenów, w jednym przypadku uzyskano wynik niediagnostyczny. W 33 badaniach wykryto jeden patogen, natomiast w 5 po 2 patogeny jednocześnie. Łącznie zidentyfikowano 9 rodzajów patogenów w tym 4 bakterie, 3 pierwotniaki oraz 2 helminty. Najczęściej diagnozowanymi patogenami były pierwotniaki, łącznie 27 pozytywnych wyników. W tej grupie Blastocystis hominis zidentyfikowano 14 razy, Dientamoeba fragilis – 12 oraz Giardia lamblia 1 raz. Bakterie zdiagnozowano łącznie w 13 przypadkach i były to: Aeromonas spp. oraz enteropatogenne pałeczki Escherichia coli, posiadające geny eaeA (5 razy), szczep Clostridium difficile, posiadający gen kodujący toksynę B (2 razy) oraz enteroagregacyjne pałeczki Escherichia coli posiadające gen aggR 1 (1 raz). Grupę najrzadziej diagnozowanych patogenów stanowiły helminty. Łącznie zidentyfikowano je w 3 przypadkach, w tym Enterobius vermicularis (2 razy) oraz Enterocytozoon spp./Encephalitozoon spp. (1 raz) (Ryc.8.).

Dyskusja
Laboratoria diagnostyczne wykonujące badania w kierunku infekcji mikrobiologicznych zobligowane są Rozporządzeniem Ministra Zdrowia do zgłaszania wyników badań w kierunku biologicznych czynników chorobotwórczych u ludzi (ostatnie opublikowane w Dzienniku Ustaw RP 26 czerwca 2020 roku; poz. 1118). W wykazie znajdują się łącznie 63 patogeny wymagające podjęcia przez organy Państwowej Inspekcji Sanitarnej działań mających na celu ochronę zdrowia publicznego. Oczywiście lista ta nie wyczerpuje wszystkich patogenów stanowiących przyczyny infekcji i podlega aktualizacji. Niestety, aby takiej aktualizacji dokonać, konieczne jest prowadzenie systematycznego monitoringu wszystkich diagnozowanych patogenów, w szczególności tych nieobjętych wykazem. Dlatego celem niniejszego opracowania jest próba oceny częstości występowania i rodzaju patogenów wywołujących infekcje układu pokarmowego w populacji polskiej. Uzyskane przez nas wyniki wskazują, że z objawami infekcji układu pokarmowego borykają się pacjenci w całej Polsce zarówno mężczyźni jak i kobiety, w ciągu całego życia. Wiek pacjentów był w przedziale od 1 roku życia do 96 lat. Dwukrotnie częściej badania zostały zlecone u osób dorosłych niż dzieci. Jest to interesujący wynik, ponieważ dzieci w szczególności w wieku przedszkolnym znacznie częściej narażone są na ryzyko infekcji układu pokarmowego. Większość rodziców tych dzieci przynajmniej raz w życiu była świadkiem objawów takich jak bóle brzucha, biegunka, wymioty, czasem z towarzyszącą wysoką gorączką. Wymienione objawy spowodowane są najczęściej przez zakażenia rotawirusem, ale również innymi enterotropowymi wirusami, bakteriami czy pierwotniakami. Z bakterii najczęstsze są zakażenia paradurami (Salmonelloza) i czerwonką (Shigella). Gronkowce lub bakterie beztlenowe (po zjedzeniu zakażonych potraw np. lodów) mogą być przyczyną masowych zatruć u dzieci. Luźne stolce i wymioty mogą prowadzić do odwodnienia i utraty elektrolitów, które mogą być bezpośrednią przyczyną zagrażających życiu powikłań. Tymczasem ilość zleconych badań u dzieci może z jednej strony świadczyć o niskiej świadomości rodziców dotyczących diagnostyki patogenów sprawczych wynikającej z szybkiego ustania objawów i braku konieczności wdrożenia leczenia farmakologicznego. Z drugiej strony, wydaje się, że obserwowany wysoki procent (67%) zleceń przez osoby dorosłe może świadczyć o braku uzyskania satysfakcjonujących wyników leczenia prowadzonego w POZ i/lub przewlekłego charakteru objawów. Niestety brak dostępu do informacji o wstępnym rozpoznaniu i dotychczas przebytym leczeniu nie pozwala na wyciągnięcie ostatecznych wniosków.
Wśród dostępnych 4 paneli infekcji układu pokarmowego pozwalających na wykrycie materiału genetycznego patogenów stanowiących najczęstszą przyczynę zakażeń najczęściej (61%) zlecany był panel identyfikujący 8 endopasożytów wielokomórkowych (płazińce, obleńce) oraz 1 endopasożyta w trzech próbkach wykryto Enterobius vermicularis (owsik ludzki-2 razy) i raz Enterocytozoon spp./Encephalitozoon spp. (1 raz). Razem stanowiły niespełna 8% wszystkich wykrytych patogenów. Dane pochodzące z WHO wskazują, że około 24% ludzi na świecie jest zainfekowanych helmintami, choć ich rozmieszczenie nie jest równomierne i wynika z panujących warunków sanitarno-higienicznych. Na bazie tych informacji wzrosło zainteresowanie pacjentów różnego rodzaju badaniami w kierunku patogenów wywołujących helmintozy oraz „moda na odrobaczanie”. Należy jednak mieć na uwadze, że samodzielne stosowanie preparatów/leków w celu „profilaktycznego pozbycia się robaków” jest nieuzasadnione i może wiązać się ze szkodliwymi skutkami zdrowotnymi. Jakiekolwiek objawy wskazujące na choroby pasożytnicze bezwzględnie powinny być skonsultowane z lekarzem i poprzedzone właściwymi badaniami diagnostycznymi.
https://www.who.int/news-room/fact-sheets/detail/soil-transmitted-helminth-infections
Spośród wykrytych patogenów najliczniejszą grupę stanowił pierwotniak Blastocystis hominis będący przyczyną choroby biegunkowej zwanej blastocystozą (32%). Pierwotniak ten bytuje w przewodzie pokarmowym człowieka i wielu zwierząt. Do zarażenia człowieka dochodzi drogą fekalno-oralną (choroba „brudnych rąk”) lub pokarmową przez zanieczyszczony cystami pierwotniaka pokarm lub wodę. Choroba ma zazwyczaj przebieg łagodny i samoograniczający. Drugi w kolejności najczęściej wykrywany patogen to jeden z mniejszych pierwotniaków pasożytujących w jelicie grubym Dientamoeba fragilis (28%), który wywołuję chorobę nazywaną dientoamebozą. Sposoby przenoszenia zakażenia nadal nie są dokładnie znane. Z kolei pałeczki E. coli stanowiły 16% wyników pozytywnych. W biuletynie „Choroby zakaźne i zatrucia w Polsce w 2019 roku” dostępnym na stronie Narodowego Instytut Zdrowia Publicznego – Państwowego Zakładu Higieny, odnotowano łącznie 586 przypadków infekcji E. coli w całej Polsce. Należy mieć na uwadze, że dane te dotyczą głównie pacjentów hospitalizowanych, a więc tych o najcięższym przebiegu choroby. Wszelkim statystykom wymykają się zakażenia, które przebiegają stosunkowo łagodnie, przez co nie podlegają diagnostyce lub diagnozowane są przez zlecania indywidualnie/prywatnie. Stąd wydaje się, że dalecy jesteśmy od poznania skali udziału poszczególnych patogenów w wywoływaniu infekcji układu pokarmowego. Dlatego wydaje się celowym prowadzenie takich statystyk przez laboratoria diagnostyczne i ich upublicznianie. Przedstawione badania mają jednak swoje ograniczenia wynikające z relatywnie małej liczby wyników, przez co niezwykle ważne jest kontynuowanie rozpoczętych już obserwacji. Równie istotne jest podkreślenie konieczności stałego i rzetelnego informowania lekarzy oraz rodziców o możliwościach i korzyściach diagnozowania czynników chorobotwórczych z wykorzystaniem coraz powszechniej dostępnych, nowoczesnych technik molekularnych, takich jak multipleksowa reakcja Real-Time PCR. Na podstawie przedstawionych wyników, można również stwierdzić, że największą wartość diagnostyczną w przypadku infekcji układu pokarmowego o nieznanym podłożu oferuje zlecenie badań we wszystkich 4 panelach diagnostycznych jednocześnie.
Pobierz artykuł w formacie pdf
Autorzy:
Dr hab. Monika Dmitrzak-Węglarz, Kierownik Laboratorium Diagnostyki Molekularnej genXone SA
Mgr Anna Brylak-Błaszków, Diagnosta Laboratoryjny Laboratorium Diagnostyki Molekularnej genXone SA
Dr Karol Szeszko, Diagnosta Laboratoryjny Laboratorium Diagnostyki Molekularnej genXone SA
Piśmiennictwo:
- Binnicker M. J.: “Multiplex Molecular Panels for Diagnosis of Gastrointestinal Infection: Performance, Result Interpretation, and Cost-Effectiveness”;Journal of Clinical Microbiology; 2015 Volume 53 Number 12.
- Korzeniewski K.: “Choroby pasożytnicze przewodu pokarmowego w Polsce” Via Medica, 2016, ISSN 1879-3590.
- Szych J.: “Rekomendacje laboratoryjnej diagnostyki zakażeń przewodu pokarmowego bakteriami rosnącymi w warunkach tlenowych oraz mikroaerofilnych”; KRDL, Warszawa 2015.
- Żabicka D.: “Metody detekcji i identyfikacji bakterii”; Zakład Epidemiologii i Mikrobiologii Klinicznej, Narodowy Instytut Leków, Warszawa.
- http://wwwold.pzh.gov.pl/oldpage/epimeld/2019/Ch_2019_Wstepne_dane.pdf
