Konsekwencje odwracalności procesów: reguła przekory Le Chateliera-Brauna, cz. I
UWAGA: prezentowany tekst jest częścią znacznie większego opracowania.
Co należy rozumieć przez regułę przekory?
Prawo działania mas już poznaliśmy, ale przy okazji poruszyliśmy kilka razy pewną kwestię – że zmieniając jakiś parametr w układzie będącym w stanie równowagi – zmienimy przy okazji położenie stanu równowagi. Zmiana położenia tego stanu oznacza, że jeśli układ był w stanie równowagi, to się zacznie zmieniać dążąc do nowej równowagi, innej niż na początku się znajdował. Jeśli jednak nie był w stanie równowagi, ale do niej dążył i w trakcie jej ustalania zmienimy jakiś parametr, to ten układ zacznie dążyć do innego stanu równowagi, niż początkowo dążył. Żeby jednak uniknąć przydługiego wstępu, podamy regułę przekory w dość podręcznikowym brzmieniu:
Jeśli na układ znajdujący się w stanie równowagi działa jakiś bodziec zmieniający jego stan, to układ przeciwdziała temu bodźcowi |
I tutaj należałoby sobie zadać pytanie, co właściwie znaczy, że przeciwdziała temu bodźcowi? W jaki sposób mu przeciwdziała? Zapomnijmy o tej definicji i zobaczmy na tę:
Jeśli na układ znajdujący się w stanie równowagi działa jakiś bodziec zmieniający jego stan, to układ stara się wrócić do stanu poprzedniego |
Czy teraz brzmi jakby jaśniej? W końcu jeśli komuś jest wygodnie na łożu i nagle mu każą się położyć na podłodze, to chyba niechętnie się tam zechce przenieść? A dlaczego reguła przekory jest konsekwencją prawa działania mas? Ze względu na stałość stałej równowagi. Weźmy np. jeśli stosunek obwodu koła do jego średnicy wynosi π, to nie ma znaczenia czy weźmiemy koło o średnicy 2 cm, czy 12 m, stosunek obwodu do średnicy zawsze wynosi π czyli ok. 3,14 bo π jest liczbą stałą. Jeśli zmienimy średnicę dwukrotnie, to obwód także wzrośnie dwukrotnie i stosunek jednego do drugiego znowu będzie wynosił π. To samo dotyczy wszelakich stałych równowagi – zmieniając jeden parametr – pozostałe zmienią się tak, że ich wartość ponownie da tę samą wartość – stałą równowagi. Dzięki zatem zarówno prawu działania mas jak i wynikającej z niego regule przekory możemy sterować położeniem stanu równowagi procesu i nadawać mu kierunek. Skupmy się teraz na konkretach!
Reguła przekory w przemianach fizycznych
Propozycja doświadczenia: na szczęście tym razem jako substancje do najprostszej demonstracji istoty zjawiska wystarczą lód (śnieg) i trochę soli kuchennej. Trochę szronu z zamrażarki lub śniegu czy też pokruszonego lodu w miseczce posypmy sporą ilością soli kuchennej. W pierwszej chwili mieszanina silnie zmarznie, a jeśli mamy do dyspozycji termometr o odpowiednim zakresie, to wskaże on nawet -22 oC (pod warunkiem, że mamy odpowiednio wykalibrowany termometr). Można po wsypaniu soli zamieszać mieszaninę ostrożnie termometrem, ale na tyle delikatnie, by nie złamać zbiorniczka z płynem, bo podczas zmrożenia zawartość miski silnie twardnieje. To teraz się zastanówmy: dlaczego nasza mieszanina jeszcze bardziej zamarzła, zamiast się roztopić? To po co sypiemy sól na drogi, aby pozbyć się lodu, skoro nasza mieszanina zamarzła? Za moment to sobie wyjaśnimy!
Reguła przekory w klasycznym kanonie nauczania jest omawiana niemal tylko pod kątem procesów chemicznych (i chyba każdy szkolny podręcznik zawiera jakże życiowy przykład: dimeryzacja NO2…). Jednakże jak pisałem poprzednio, prawo działania mas obejmuje zarówno przemiany fizyczne jak i chemiczne. Niezależnie bowiem od typu przemiany opisujemy je tymi samymi funkcjami termodynamicznymi: entalpią (H), entropią (S), entalpią swobodną (G), oraz za pomocą stałej liczby (K), określającej położenie stanu równowagi przemiany – zarówno spalanie wodoru jak i parowanie wody, czyli proces chemiczny jak i fizyczny, to każdą przemianę możemy też opisać odpowiednim równaniem, np. parowanie wody:

Da się? Da się, przecież już to robiliśmy na samym początku tego rozdziału. Zanim jednak rozważymy to bardziej szczegółowo, zastanówmy się nad tymi pytaniami:
1) dlaczego jeśli polać się eterem lub acetonem to czuć przenikliwe zimno? Dlaczego termometr wstawiony do tych cieczy w otwartym pojemniku pokazuje spadek temperatury znacznie poniżej temperatury otoczenia?
Postaram się w jasny sposób to wyjaśnić. A zaczniemy od parowania cieczy. Eter dietylowy, zwany potocznie po prostu eterem, jest cieczą słabo mieszającą się z wodą i ma temperaturę wrzenia 37 oC. Po otwarciu butelki czujemy jego słodki zapach, ciecz ta bowiem intensywnie paruje:

Pisałem już o eterze, że latem często podskakują korki w butelkach, a nawet potrafią wystrzelić. Dzieje się tak dlatego, że w temperaturze pokojowej eter znajduje się zaledwie kilkanaście stopni od swojej temperatury wrzenia, a latem nieraz i zaledwie kilka stopni. Odnosząc to do wody, to w eter w temperaturze pokojowej zachowuje się podobnie jak woda w ok. 90 oC! Eter ma wysoką prężność pary nasyconej w temperaturze pokojowej (rozdział o równowadze ciecz-para). Po otwarciu butelki, w której ciecz znajduje się w równowadze z parami, pary wydostają się na zewnątrz i ich ciśnienie (prężność) w butelce spada. A skoro tak, to układ, zgodnie z tym co powiedzieliśmy, powinien ten stan odbudować, odtworzyć to ciśnienie par, zatem ciecz zaczyna intensywnie parować. Ale z drugiej strony, ciecz też się dobrze czuje jako ciecz, to po co ma parować? Ciecz to w tych warunkach stan korzystniejszy! Ciecz chce pozostać cieczą! Co ciecz może więc zrobić? Ochłodzić się, bo w niższej temperaturze parowanie jest wolniejsze i spada prężność pary nasyconej. Zjawisko to obserwujemy dla wszystkich cieczy – parująca ciecz obniża swoją temperaturę by mogła pozostać cieczą. Parowanie jest więc procesem endotermicznym – jak widać reguła przekory pozwala przewidzieć także efekt energetyczny przemiany! Żeby podtrzymać parowanie musimy dostarczać ciepła cieczy, w przeciwnym przypadku zostaje ono mocno ograniczone, a parujący eter czy chlorek metylenu potrafi obniżyć swoją temperaturę znacznie poniżej zera. A ten fakt wykorzystywałem kiedyś do ekspresowej produkcji lodu: do kolby ssawkowej wlewałem wody, następnie chlorku metylenu i podłączałem pod próżnię – obniżenie ciśnienia powodowało błyskawiczne parowanie chlorku metylenu i takie obniżenie temperatury, że w kolbie pozostawały grudki lodu w ciągu zaledwie kilkunastu sekund! Jeśli polejemy się eterem, acetonem lub chlorkiem metylenu, to czujemy przenikliwe zimno. Jeśli polejemy eterem lub chlorkiem metylenu kawałek bibuły, to po chwili obrośnie… szronem. A co się dzieje, gdy wychodzimy mokrzy z wanny lub kabiny prysznicowej? Jest nam wtedy ciepło czy zimno i dlaczego? Czy i woda może ochłodzić się poniżej temperatury otoczenia? Może, choć ze względu na jej powolne parowanie w temperaturze pokojowej jest to trudniejsze do zaobserwowania. Jest to natomiast widoczne w chłodniach kominowych. Na rysunku 10 widzimy chłodnię kominową elektrowni Bełchatów. Mimo potężnej konstrukcji, chłodnie wcale nie stykają się podłożem bezpośrednio – są ustawione na podporach, w wewnątrz zaś wypełni

one są rusztowaniem, po którym spływa ciepła woda. Woda ta paruje i przy okazji ogrzewa powietrze, które zaczyna unosić się w górę. Woda parując ochładza się nawet o kilka stopni poniżej temperatury otoczenia – właśnie po to, by ograniczyć parowanie. Właśnie dlatego chłodnie są ustawione na filarach, by zapewnić dopływ świeżego (i suchszego) powietrza od dołu, zaś schłodzona woda wraca do obiegu technologicznego, a ogrzane powietrze nasycone parą wodną jako lżejsze – uchodzi górą.
Zagadka 1.1: czy skraplanie par jest procesem endotermicznym, czy egzotermicznym i dlaczego?
2) dlaczego woda amoniakalna pozostawiona w otwartym naczyniu stygnie znacznie poniżej temperatury otoczenia?
Amoniak jest gazem dobrze rozpuszczalnym w wodzie – handlowy odczynnik zwany amoniakiem, jest w istocie rzeczy 25% wodnym roztworem tego gazu i z tego powodu poprawniej zwać go wodą amoniakalną. Gazy lepiej rozpuszczają się w cieczach na zimno niż na gorąco. Zdajemy sobie też sprawę, że gazy rozpuszczone w cieczy występują zawsze w równowadze z gazem nad roztworem (prawo Henry’ego). Pozostawiając jednak otwarty pojemnik z wodą amoniakalną na powietrzu gaz, który znajdował się z równowadze z roztworem zaczyna dyfundować do powietrza, zatem ciśnienie tego gazu spada – roztwór próbuje to odbudować i uwalnia część gazu rozpuszczonego w sobie – niestety na próżno, bo ten gaz rozprasza się po całej przestrzeni wskutek dyfuzji, więc gaz zaczyna swobodnie opuszczać roztwór. Oczywiście roztwór chce pozostać roztworem! Co więc może zrobić? Obniżyć swoją temperaturę, podobnie jak to czyni parująca ciecz! W niższej temperaturze bowiem rozpuszczalność gazów jest lepsza, a ponadto proces opuszczania gazu z roztworu zachodzi wolniej. I ponownie znając rozpuszczalność gazów w zależności od temperatury reguła przekory pozwala nam przewidzieć zachowanie się układu. Układ zawsze zareaguje tak, by się bronić przed zmianą i co ważne – w sposób w jaki to może wykonać.
Zagadka 2.1: rozpuszczając amoniak w wodzie, zaobserwujemy wzrost, czy spadek temperatury?
3) Czy woda może być cieczą na mrozie? Zjawisko przechłodzenia cieczy
W dobie internetu i modnych różnych filmików w nim zamieszczanych można często znaleźć sztuczkę z mrożonym piwem, które jest ciekłe, a po uderzeniu w dno zawartość butelki zestala się w kilka sekund. Jak to się stało i dlaczego? To zjawisko jest powszechne i nosi nazwę przechłodzenia – ciecz mimo ochłodzenia poniżej temperatury krzepnięcia, pozostaje w stanie ciekłym. Oczywiście, nie jest to stan trwały, bo mimo wszystko ciecz powinna przejść w ciało stałe w temperaturze krzepnięcia. Rozpatrzmy to więc na przykładzie wody, bo tak będzie najprościej. Jak wiemy, ta zamarza w temperaturze 0 oC. Może się jednak zdarzyć, że woda ochłodzi się do temperatur ujemnych i nie zamarznie – taką ciecz zwiemy właśnie cieczą przechłodzoną. Jednakże zakłócenie tego stanu – kończy się gwałtowną krystalizacją (zestaleniem) tej cieczy. Ale to nie wszystko! Dodatkowo towarzyszy temu ogrzanie do 0 oC. A dlaczego się ogrzewa i to akurat do 0 oC? Bo ciecz, nawet jeśli przechłodzona, to na zmianę, czyli rozpoczęcie krystalizacji, próbuje pozostać tą cieczą, nawet mimo tego że jest przechłodzona! W końcu znajdowała się w jakiejś równowadze z otoczeniem. Ogrzewa się przy tym do temperatury topnienia, bo jest to temperatura, w której ciecz występuje w równowadze z ciałem stałym czyli z lodem w tym przypadku. W temperaturze 0 oC woda ani nie zamarza – ale uwaga, bez zewnętrznej wymiany ciepła z otoczeniem, ani lód się nie topi, – ale uwaga, także bez zewnętrznej wymiany ciepła z otoczeniem, więc ogrzanie się do temperatury 0 oC pozwala wodzie, która nie zdążyła zamarznąć, pozostać w stanie ciekłym, więc jeśli nie ma dodatkowej wymiany ciepła z otoczeniem, to otrzymamy mieszaninę wody ciekłej z lodem. Woda ponownie zareagowała w sposób jaki może się przed zmianą obronić – ogrzać się. Szczególnie spektakularnymi przykładami cieczy przechłodzonych są stopione uwodnione sole: siarczan sodu Na2SO4*10H2O, tiosiarczan sodu Na2S2O3*5H2O i octan sodu CH3COONa*3H2O. Pierwszy topi się w 32 oC, drugi w 48 oC, a trzeci w 55 oC i jeśli je stopić i pozostawić do ostygnięcia w spokoju, to zazwyczaj nie krzepną pomimo ochłodzenia do temperatury pokojowej, zatem sporo poniżej temperatury krzepnięcia. Jednakże wystarczy wrzucić kryształek, który stanie się zarodkiem krystalizacji, lub wstrząsnąć energicznie (a czasem tylko lekko przechylić naczynie z cieczą) i rozpoczyna się gwałtowny proces krystalizacji. Ale to nie wszystko, co temu towarzyszy: pierwszy ogrzewa się do 32 oC, drugi do 48 oC, a trzeci do 55 oC! Teraz już wiecie dlaczego? Tiosiarczan sodu a ostatnio także octan sodu znalazły zastosowanie w kieszonkowych ogrzewaczach na zimę – torebkach wypełnionych tym związkiem, które dodatkowo posiadają sprężysty metalowy klips – jego naciśnięcie powoduje dostarczenie energii do pobudzenia krystalizacji i ogrzanie do 48 lub 55 oC, zależnie od tego, czy w środku był tiosiarczan sodu czy octan sodu.
Wróćmy jeszcze do wody. Skutki przechłodzenia i gwałtownej krystalizacji możemy zaobserwować jako spektakularne zjawisko zwane prześwitem poopadowym. Chmury to często układ kropelek wody przechłodzonej, ale wystarczy jakieś zaburzenie równowagi, jak przelatujący ptak czy samolot i przechłodzona woda zaczyna krystalizować gwałtownie, krystalizujące maleńkie kropelki zderzając się z innymi powodują krystalizację następnych. Ze względu na ujemną temperaturę powietrza wokół nich, woda mimo podgrzania się do 0 oC nie jest utrzymać się w równowadze ciecz-ciało stałe i po prostu cała zamarza. Wkrótce zamarznięte krople opadają, a w chmurze pozostaje otwór, zwany właśnie prześwitem poopadowym, co widzimy na zdjęciu.

4) Dlaczego rozpuszczając saletrę amonową w wodzie można otrzymać przy okazji lód? Rozpuszczanie soli nie tworzących hydratów w wodzie i efekt energetyczny ich rozpuszczania
Jednym z podstawowych nawozów azotowych jest saletra amonowa, czyli azotan amonu NH4NO3. Jest to związek bardzo dobrze rozpuszczalny w wodzie. Gdybyśmy jednak wsypali do szklanki wypełnionej częściowo wodą wsypali sporą porcję tego związku i zaczęli mieszać, to oczywiście sól ta zacznie się szybko rozpuszczać ale… Towarzyszy temu silny spadek temperatury! Tak silny, że po chwili zewnętrzna ścianka szklanki obrasta… szronem. Termometr pokaże nawet – 20 oC! Ale dlaczego i skąd? Spójrzmy na równania przemiany:

Po lewej stronie mieliśmy stan początkowy, czyli czystą wodę i czystą saletrę w osobnych fazach, z kolei po prawej mamy roztwór saletry w wodzie. Jak więc zareaguje układ? Po raz kolejny zacznie się bronić – przed rozpuszczaniem i tworzeniem roztworu. Spójrzmy na rozpuszczalność tej soli w wodzie pokazaną na rysunku 12.
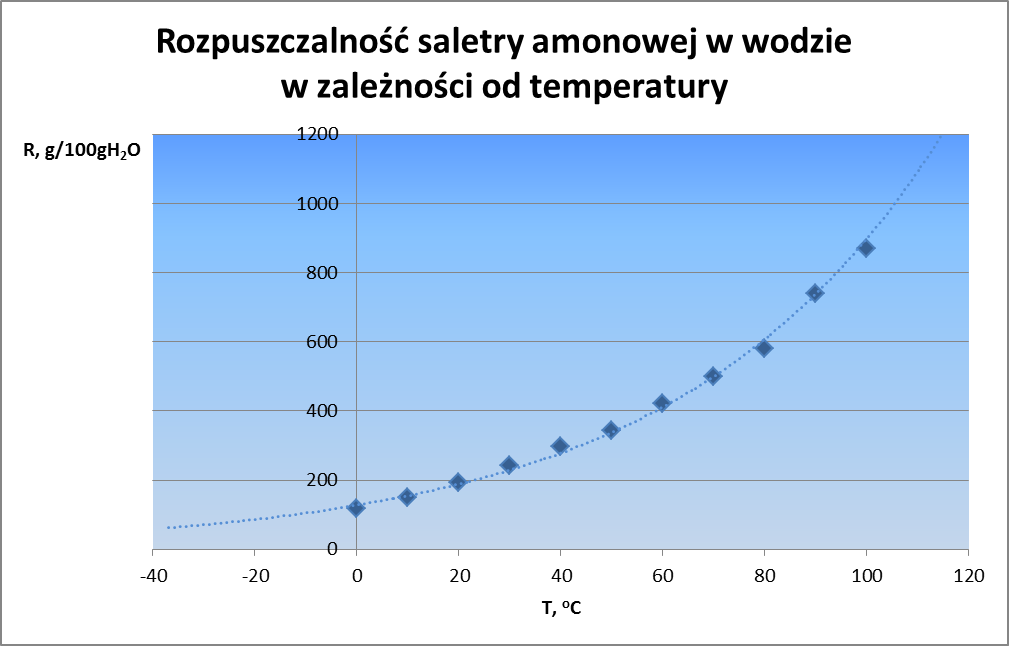
W temperaturze 0 oC wynosi ona 118 g, w 20 już 192 g ,a w 100 – aż 871 g! Rozpuszczalność tej soli mocno zależy od temperatury. Oczywiście ochładzając nasycony roztwór będą z niego wypadać kryształy, ale co poniżej zera? Roztwory mają niższą temperaturę krzepnięcia niż czyste rozpuszczalniki, dlatego można je ochłodzić poniżej temperatury zamarzania rozpuszczalnika i nadal będzie z niego wypadać osad substancji rozpuszczonej aż do właściwej temperatury zamarzania roztworu, która w przypadku saletry amonowej wynosi -35 oC (238 K). Jednakże zauważmy, że mniejsza rozpuszczalność, to większa szansa na to, że stała saletra pozostanie nierozpuszczona, a woda będzie „bardziej wodą”, bo będzie zawierać w stanie nasyconym mniejsze stężenie saletry. Co więc układ może zrobić by przeciwdziałać zmianie, czyli rozpuszczaniu? Ochłodzić się. Zjawisko obniżenia temperatury zaobserwujemy także rozpuszczając w sodzie chlorek sodu, albo zwykły cukier. Zatem rozpuszczanie substancji, których rozpuszczalność rośnie wraz z temperaturą, jest procesem endotermicznym. Po raz kolejny reguła przekory pozwoliła nam przewidzieć efekt energetyczny przemiany. Zaś nasz poczciwy azotan amonu – ze względu na dostępność jak i duży efekt termiczny znalazł zastosowanie do produkcji kompresów chłodzących. No i można sobie za jego pomocą wyhodować trochę lodu.
Zagadka 4.1: istnieją związki, których rozpuszczalność maleje wraz ze wzrostem temperatury (a więc odwrotnie niż azotan amonu czy cukier). Jakie będą obserwacje (wzrost czy spadek temperatury) podczas rozpuszczania tych substancji?
Zagadka 4.2: rozpuszczalność chlorku sodu (czyli soli kuchennej) w wodzie niewiele się zmienia z temperaturą. Czy zaobserwujemy duży efekt termiczny podczas rozpuszczania tego związku w wodzie?
Zagadka 4.3: dlaczego gorący nasycony roztwór azotanu amonu stygnie bardzo powoli?
Zagadka 4.4: dlaczego strącanie osadów soli w reakcji wymiany jest zazwyczaj procesem egzotermicznym?
Zagadka 4.5: czy rozpuszczanie gazów stosuje się do tej samej zasady?
5) Przypadek związków tworzących hydraty i ich zachowanie w kontakcie z wodą. Czy kwas siarkowy podczas rozpuszczania w wodzie może powodować jej ochłodzenie?
Wśród pospolitych soli znajdujących się w użyciu laboratoryjnym znajdują się siarczan miedzi CuSO4 i siarczan magnezu MgSO4. Jednakże te sole tworzą hydraty i taki siarczan miedzi zazwyczaj jest stosowany jako pięciowodny CuSO4*5H2O lub bezwodny CuSO4, z kolei siarczan magnezu jako siedmiowodny MgSO4*7H2O lub bezwodny MgSO4. Sole uwodnione ogrzewane do wysokich temperatur przechodzą w bezwodne, więc można łatwo hydrat przekształcić w sól bezwodną. Gdybyśmy jednak do słoika z bezwodnym siarczanem magnezu MgSO4 wlali trochę wody, to zaobserwujemy szybkie nagrzewanie się słoika aż do nawet ponad 100 oC! I po raz kolejny: dlaczego? Zapiszmy to sobie jako przemianę:

Początkowo w układzie mieliśmy dwa związki osobno, które zmieszane razem tworzą krystaliczny hydrat MgSO4*7H2O. Skoro hydraty na gorąco tracą wodę, to jak zachowa się układ w wyniku kontaktu bezwodnego MgSO4 z ciekłą wodą? Bezwodna sól chce pozostać bezwodną solą, woda wodą! W wysokich temperaturach obie substancje mogą istnieć samodzielnie, więc układ podnosi temperaturę, by zapobiec uwodnieniu! Zatem hydratacja soli bezwodnych musi być procesem egzotermicznym. Oczywiście otoczenie systematycznie odbiera ciepło z układu i hydrat jednak powstanie.
Co jednak się stanie, gdybyśmy otrzymany hydrat MgSO4*7H2O próbowali rozpuścić w wodzie? Zaobserwujemy spadek temperatury, podobnie jak to było w przypadku saletry amonowej… Czy już wiecie dlaczego? Dlatego, że teraz z kolei układ stara się zapobiec rozpuszczaniu, a rozpuszczalność tego hydratu rośnie wraz z temperaturą.
Zagadka: co by się stało, gdybyśmy bezwodny siarczan magnezu wrzucili do takiego nadmiaru wody, że wody wystarczyłoby nie tylko do utworzenia hydratu, ale i do jego rozpuszczenia? Czy zaobserwujemy ogrzanie się układu, czy ochłodzenie? Jakie prawo pozwala nam uzyskać odpowiedź, jeśli znamy efekty energetyczne zarówno hydratacji jak i rozpuszczania hydratu?
Chodzi oczywiście o prawo Hessa, które jak przypomnę mówi o tym, że efekt energetyczny nie zależy od drogi przeprowadzenia procesu, tylko od stanu początkowego i końcowego. Spójrzmy na schemat na rysunku 13:
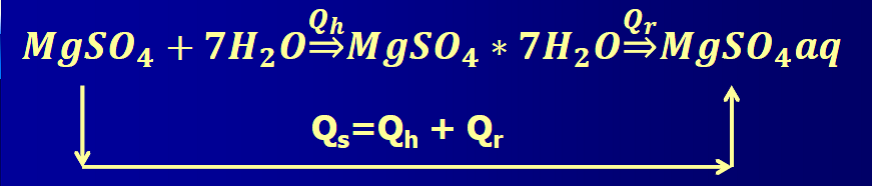
Nieważne, czy najpierw uwodnimy siarczan magnezu, a potem rozpuścimy hydrat i otrzymamy roztwór, czy też zadamy bezwodny siarczan magnezu odpowiednim nadmiarem wody by rozpuścić bezwodny siarczan, to otrzymamy to samo i w obu przypadkach bilans cieplny będzie taki sam. Całkowite ciepło (Qs) tego drugiego procesu będzie równe sumie efektów cieplnych procesów elementarnych: ciepła hydratacji i ciepła rozpuszczania (Qh+Qr). Ale uwaga! Przecież efekty energetyczne mogą być przeciwnych znaków, o ile hydratacja jest procesem egzotermicznym, o tyle rozpuszczanie już przeważnie endotermiczne, więc te dwa efekty cieplne są zazwyczaj przeciwnych znaków, i w tym przypadku sumaryczny efekt Qs będzie zależał od tego, czy większe jest ciepło hydratacji, czy rozpuszczania. Jeśli ciepło hydratacji jest większe niż ciepło rozpuszczania, to efekt nadal będzie egzotermiczny, mimo że efekty te zazwyczaj są przeciwnych znaków. A ciepło wydzielone podczas hydratacji siarczanu magnezu jest większe niż ciepło pobierane z otoczenia podczas endotermicznego rozpuszczania, więc sumaryczny efekt w tym przypadku będzie egzotermiczny i zaobserwujemy wzrost temperatury.
By nie stracić swej urody…
Wlewaj zawsze kwas do wody. Chodzi oczywiście o kwas siarkowy. Stężony kwas siarkowy rozpuszcza się w wodzie wydzielając duże ilości ciepła i krążą o tym wierszyki. Jednak dlaczego ten kwas rozpuszcza się z dużym efektem egzotermicznym? Jak jednak wyjaśnić fakt, że rozcieńczony kwas siarkowy służy do sporządzania… mieszanin oziębiających (jak woda z azotanem amonu)? Odpowiedź jest prosta: bo kwas siarkowy tworzy z wodą hydraty, które są ciekłe w temperaturze pokojowej. Przecież nikt nie mówi, że hydrat musi być w temperaturze pokojowej (lub niewiele od niej odbiegającej) ciałem stałym! Nawet uwodniony siarczan sodu topi się w zaledwie 32 oC! A skoro kwas siarkowy jest w stanie utworzyć z wodą hydraty, podobnie jak siarczan magnezu je tworzy, to skoro uwodniony siarczan rozpuszcza się endotermicznie w wodzie, to co w przypadku kwasu siarkowego? Czy taki hydrat kwasu siarkowego także dodany do wody pozwoli obniżyć temperaturę układu? Wg wszelkich prawideł to tak, gdyż wszystkie substancje podlegają tym samym prawom (tzw. „wyjątki” które każą nam zapamiętać w szkole, nie są wyjątkami w rzeczywistości, ale ubogość i dziurawość materiału szkolnego nie pozwala na powiązanie wielu rzeczy ze sobą). Zatem jeśli uprzednio rozcieńczony kwas siarkowy (będący w gruncie rzeczy ciekłym hydratem) mieszać z kolejną porcją wody, to podobnie jak hydrat siarczanu magnezu rozpuszczał się endotermicznie, tak i hydrat kwasu siarkowego się rozpuszcza endotermicznie. Ok, ale dlaczego wlewając stężony kwas siarkowy do nadmiaru wody obserwujemy jej ogrzanie? To spójrzmy jeszcze raz co napisałem o prawie Hessa wyżej.
6)Tajemnica doświadczenia z lodem i solą. Dlaczego sypiemy sól na drogi?
Pora w końcu wyjaśnić, dlaczego lód posypany dużą ilością soli obniża swoją temperaturę aż do -22 oC. Co więcej, jeśli powtórzyć to doświadczenie biorąc lód o dwóch różnych temperaturach, np. 0 i -15 oC, to w obu przypadkach temperatura spadnie do -22 oC. A to jeszcze nie wszystko: lód posypany saletrą amonową obniża temperaturę do -35 oC! A żeby było jeszcze śmieszniej, to 92 g 66% H2SO4 zmieszane ze 100 g lodu lub śniegu – obniża temperaturę do -37 oC! Dwa szczegóły powinny już zwrócić naszą uwagę: że w przy omawianiu azotanu amonu padła już temperatura -35 oC, a przy omawianiu hydratów udowadniałem, że i kwas siarkowy rozpuszcza się w wodzie endotermicznie, pod warunkiem, że utworzył wcześniej z wodą hydrat. Gdybyśmy ochładzali nasycony roztwór chlorku sodu do zera stopni, to wypadają z niego kryształy, bo maleje rozpuszczalność tej soli. Jednakże ten roztwór możemy ochłodzić aż do -22 oC – w tej temperaturze zamarza nasycony roztwór NaCl, tworząc tzw. lód eutektyczny. Azotan amonu osiąga ten sam stan przy -35 oC – tworzy lód eutektyczny przy takiej właśnie temperaturze. Poniżej temperatury krzepnięcia roztworu sól nie rozpuszcza się już w wodzie. Ponieważ, jak już się pewno przyzwyczailiśmy – układ stara się zachować swój stan: lodu i soli w osobnych fazach, przeto obniża swoją temperaturę do takiej, w której nie będzie następować rozpuszczanie, co w przypadku chlorku sodu oznacza -22 oC. Z kolei -37 oC to temperatura zamarzania 32% roztworu H2SO4. Policzcie już sami, czy mieszając 92 g 66% H2SO4 ze 100 g wody otrzymamy roztwór o takim stężeniu.
Co by się jednak stało, gdyby użyć soli kuchennej i lodu o temperaturze np. -30 oC. Odpowiedź brzmi: nic. W tej temperaturze sól kuchenna nie rozpuszcza się już w wodzie, bo jest to temperatura poniżej zamarzania nasyconego roztworu. Zmiany zaobserwowali byśmy dopiero dla saletry amonowej i rozcieńczonego H2SO4 do 66%. Zatem skoro lód posypany solą kuchenną NaCl ulega jeszcze większemu zmrożeniu, to dlaczego sypiemy sól na drogi? Bo otoczenie zazwyczaj jest cieplejsze niż -22 oC. Mimo, że lód w akcie obronnym ulega zmrożeniu, to tak jak było dotychczas – wymiana ciepła z otoczeniem powoduje jego podgrzanie i nieuchronne stopienie… Ale tylko gdy temperatura wynosi powyżej -22 oC. W przypadku silniejszych mrozów należałoby użyć innego związku, np. saletry amonowej, bo 66% kwasu siarkowego lepiej może nie używać. Dlatego np. w Moskwie sypanie solą nie zawsze przynosi skutek.
7) jak działa lodówka?
Samorzutny kierunek przepływu ciepła jest zawsze od ciała o temperaturze wyższej, do ciała o temperaturze niższej. Lodówka przekazuje ciepło w kierunku przeciwnym – pobiera ciepło z układu o temperaturze niższej i przekazuje je do cieplejszego otoczenia. W jako sposób jest to możliwe? Generalnie urządzenia transportujące coś w kierunku przeciwnym do samorzutnego zwiemy pompami. Lodówka i klimatyzacja są przykładami pomp ciepła – transportują ciepło w kierunku przeciwnym do samorzutnego. I może wydawać się to dziwne, ale korzystamy z dobrodziejstw reguły przekory na co dzień w domu. Jest to możliwe dzięki zastosowaniu taniej sztuczki. Lodówka wykorzystuje fakt, że parowanie cieczy jest procesem endotermicznym, a skraplanie – egzotermicznym. Pary podczas zwiększania ciśnienia w pewnym momencie zaczynają się skraplać – ciśnienie, przy którym to następuje zwiemy prężnością pary nasyconej. Dalsze ściskanie par nie powoduje już wzrostu ciśnienia, tylko skraplanie cieczy. Woda w temperaturze 100 °C ma prężność par równą 1013 hPa. Gdybyśmy parę wodną o tej temperaturze, ale niższym ciśnieniu zaczęli ściskać (sprężać), to zgodnie z prawami gazowymi możemy to zrobić aż do momentu, w którym para osiągnie 1013 hPa. Dalsze zmniejszanie objętości układu nie spowoduje już wzrostu ciśnienie, tylko skroplenie odpowiedniej ilości pary, by ciśnienie cały czas było równe 1013 hPa. ALE! Wiemy przecież, że para chce pozostać parą – podnosi swoją temperaturę, by powstrzymać skraplanie. Właśnie to robi kompresor w lodówce – przepompowuje i spręża pary czynnika chłodzącego w układzie rurek na zewnątrz lodówki, co powoduje ich częściowe skroplenie i wzrost temperatury – jeśli mieliśmy okazję ich dotknąć, to wiemy, że są ciepłe. Jednakże chłodniejsze otoczenie pobiera ciepło i studzi te skropliny, czyli obniża ich temperaturę. Do dławika (rurki kapilarnej) trafia więc ciecz uboższa w ciepło (chłodniejsza), niż początkowo miały pary. Następnie pary są tłoczone przez kapilarę oddzielający strefę wysokiego ciśnienia od niskiego. Po przejściu przez nią ciecz trafia do strefy niskiego ciśnienia, gdzie może zacząć parować. Jednakże ciecz chce pozostać cieczą! Obniża swoją temperaturę, by ograniczyć parowanie. Strefa parowania znajduje się w systemie rurek wewnątrz lodówki – można je zobaczyć w zamrażalniku, a inne są ukryte pod wewnętrzna wyściółką. Ciecz obniżyła swoją temperaturę by zatrzymać parowanie, ale to z kolei sprawia, że cieplejsze wnętrze lodówki zaczyna przekazywać ciepło do chłodniejszych rurek z cieczą. Ciecz więc pobiera ciepło z wnętrza lodówki, które pobudza ją do dalszego parowania. Następnie pary są tłoczone do strefy sprężania – chłodnicy z tyłu lodówki i obieg się zamyka. Teraz znowu nastąpi skroplenie, podniesienie temperatury przez skraplające się pary i chłodzenie przez otoczenie. Oczywiście by lodówka mogła działać, temperatura otoczenia musi być niższa, niż temperatura skroplin w chłodnicy. Zatem sumarycznie – wnętrze lodówki przekazało ciepło parującej cieczy, a po przepompowaniu do strefy skraplania – skropliny oddały to ciepło do otoczenia. kluczową rolę pełni tutaj rurka kapilarna, która umożliwia utrzymanie różnicy ciśnienie po obu stronach. Przetłoczenie cieczy przez rurkę o małej średnicy wymaga bowiem większego ciśnienia z tej strony, od której wtłaczamy ciecz lub gaz (spróbujmy wydmuchać powietrze z płuc przez igłę lekarską, to się o tym sami przekonamy). A co dopiero przetłoczenie cieczy przez kapilarę o średnicy 0,6 mm i długości 2 metrów, która pełni rolę dławika w lodówkach.

Podsumowanie:
Tak oto przebrnęliśmy przez regułę przekory w procesach fizycznych (no, może w przypadku hydratacji można dyskutować, czy to przemiana fizyczna czy chemiczna). Czy pamiętacie śmierdzące papierosami firanki, o których już pisaliśmy? Dlaczego je wietrzymy by się pozbyć zapachu? Potraficie to już wyjaśnić w oparciu o regułę przekory? A teraz zajmiemy się regułą przekory w reakcjach chemicznych.
Opracowanie: DMchemik®. Wszelkie prawa zastrzeżone
ODPOWIEDZI DO ZAGADEK:
1.1) Skraplanie cieczy jest procesem egzotermicznym. Wynika to z faktu, że jeśli proces w jedną stronę posiada jakiś efekt energetyczny, to proces odwrotny posiada taki sam efekt, ale przeciwnego znaku. Skoro parowanie było endotermiczne bo układ bronił się przed parowaniem, to skraplanie jest egzotermiczne – podniesienie temperatury sprzyja parowaniu, czyli ogranicza skraplanie.
2.1) Skoro amoniak opuszczając roztwór powoduje spadek temperatury, to rozpuszczając się w wodzie (proces odwrotny) powoduje jej wzrost.
4.1) Wzrost temperatury. Wszystkie substancje, których rozpuszczalność maleje ze wzrostem temperatury mają egzotermiczny efekt rozpuszczania – podnosząc temperaturę układ ogranicza rozpuszczalność
4.2) Nie, gdyż zmiana temperatury nie wiąże się z dużą korzyścią przekładającą się w ograniczeniu rozpuszczania.
4.3) Azotan amonu jest nader dobrze rozpuszczalny w gorącej wodzie, ale aby rozpuścić taką ilość tej soli – trzeba było przeciwdziałać endotermicznemu efektowi rozpuszczania i dostarczyć dużej ilości ciepła – stygnięcie tego roztworu wiąże się z krystalizacją azotanu amonu – układ próbuje bronić się przed nią a na gorąco rozpuszczalność jest lepsza, zatem wydziela duże ilości ciepła i w rezultacie stygnie bardzo powoli.
4.4) Większość soli lepiej rozpuszcza się na gorąco. Układ próbuje przeciwdziałać strącaniu podnosząc temperaturę, bo wtedy osad ma wyższą rozpuszczalność.
4.5) Tak (patrz zagadka 2.1 z amoniakiem) – rozpuszczalność jest mniejsza w gorącej wodzie niż w zimnej – rozpuszczając amoniak w wodzie – układ ogranicza proces podnosząc temperaturę, usuwając amoniak z wody – układ obniża temperaturę ograniczając usuwanie amoniaku. Wszystkie przemiany i substancje rządzą się tymi samymi prawami, więc gazy nie są tutaj wyjątkami.
CZY TEN ARTYKUŁ OKAZAŁ SIĘ POMOCNY? MASZ DODATKOWE SUGESTIE ALBO PYTANIA? NAPISZ DO NAS! A MOŻE CHCESZ TEŻ O CZYMŚ NAPISAĆ I OPUBLIKOWAĆ? DOŁĄCZ DO NAS! REDAKCJA@BIOMIST.PL

Aż żałuję, że nie uczyłam się chemii w szkole!