Obojętność wody
Czy kiedykolwiek zadaliście sobie pytanie, dlaczego woda jest obojętna? Co właściwie o tym decyduje? Dlaczego w tradycyjnym podziale związków nieorganicznych wyróżniamy kwasy, zasady (gdzie należą wodorotlenki), tlenki i sole? Dlaczego posługujemy się taki podziałem akurat, że tlenki stanowią osobną grupę, zamiast należeć np. do soli? Jak to już nieraz bywało, do napisania tego artykułu skłoniło mnie pytanie na forum, dotyczące pewnego zadania maturalnego, by uszeregować związki wg rosnącej kwasowości, a wśród nich była woda.
Jeśli popatrzymy na położenie tlenu w układzie okresowym, to po lewej ma za sąsiada N, a po prawej F, a pod sobą S. Wszystkie 4 pierwiastki tworzą odpowiednie związki z wodorem: NH3 (który powinien być poprawnie zapisywany jako H3N, jednak ze względów historycznych posługujemy się zapisem NH3), H2O, HF i H2S. Gdybym teraz kazać przydzielić poszczególny związek do jakiejś grupy, to NH3 byłby zaliczony do zasad, H2O do tlenków a HF i H2S do kwasów. Woda jest obojętna. Ale dlaczego jest obojętna, podczas gdy pokrewne z nią związki są zasadami albo kwasami?
To właśnie woda towarzyszy nam na co dzień, jest środowiskiem życia, środowiskiem reakcji biochemicznych, zasadniczo jest to najpowszechniejszy rozpuszczalnik w warunkach ziemskich, więc odkąd tylko pojawiła się ludzkość – służyła w życiu codziennym, a z czasem, gdy pojawiły się już podwaliny chemii, czyli alchemia, to właśnie woda była podstawowym rozpuszczalnikiem licznych związków i reakcji wykonywanych na tych związkach. To właśnie po zachowaniu się danej substancji w wodzie określamy, czy jest ona kwasem czy zasadą, ale jak pokażę, nie możemy być tacy pewni swoich słów. Tak naprawdę, woda jest kwasem, a jej obojętność jest terminem umownym, bo woda służy nam do określania czy coś jest kwasem czy zasadą, przez odniesienie do wody. Suchy gazowy amoniak NH3 nie barwi papierka wskaźnikowego, jednak jeśli wprowadzić ten gaz do wody, to odczyn się zmieni na zasadowy. Podobnie będzie z HF, który w nieobecności wilgoci nie barwi papierka wskaźnikowego, a po wprowadzeniu do wody nadaje jej kwasowy odczyn. Ciekła woda ulega w niewielkim stopniu dysocjacji:

Jedna cząsteczka wody zachowała się jak kwas, czyli oddała proton H+, a druga jak zasada – przyjęła ten proton. Woda ma odczyn obojętny, bo liczba jonów odpowiedzialnych za odczyn kwasowy jak i za odczyn zasadowy jest równa. Z kolei jeśli do wody wprowadzimy amoniak, to część jego cząsteczek zostanie przez wodę sprotonowanych:

Teraz z kolei cząsteczka amoniaku przyjęła proton, czyli stała się zasadą, a woda kwasem. Ok, patrzymy dalej, wprowadzamy HF do wody:

teraz z kolei to woda stała się zasadą, czyli akceptorem wodoru. Ale zobaczmy co się dzieje w ciekłym amoniaku:

Z kolei ciekły HF dysocjuje analogicznie:
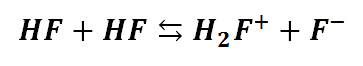
Jedna cząsteczka znowu jako zasada, a druga jako kwas. Są to przecież sytuacje analogiczne, jak w przypadku czystej wody. Nie należy mylić skroplonych gazów z wodnymi roztworami tych gazów, co czasem się zdarza! Ale do rzeczy. Miarą kwasowości jest łatwość, z jaką dany związek oddaje proton, z kolei miarą zasadowości jest łatwość, z jaką dana cząsteczka ten proton przyjmuje. Woda okazała się silniejszym kwasem niż amoniak, z kolei słabszym kwasem fluorowodór. Jest za to silniejszą zasadą niż fluorowodór, bowiem właściwości kwasowe rosną w prawo okresu, zaś zasadowe w lewo. Ciekły amoniak dysocjuje w mniejszym stopniu niż ciekła woda, z kolei ciekła woda dysocjuje słabiej niż ciekły fluorowodór, więc to co łatwiej oddaje proton, wpycha go temu, co swój własny proton oddaje trudniej. Żeby sobie to jakoś bardziej unaocznić, to wyobraźmy sobie, że mamy 2 pomieszczenia: chłodnię (-20 oC) i cieplarnię (+35 oC). Wchodząc do chłodni powiemy, że jest tam zimno, a do cieplarni, że jest tam ciepło, a nawet gorąco. Jednakże, jeśli przejdziemy z cieplarni do pokoju, w którym panuje 20 oC, to powiemy, że jest tam zimniej niż w cieplarni, ale cieplej niż w chłodni. Jeśli teraz przejdziemy do pokoju, gdzie panuje +15 oC, to z kolei powiemy, że jest tam chłodniej niż w tym poprzednim, ale cieplej niż w następnym pokoju, gdzie jest +10 oC. Tak samo dzieje się z naszą kwasowością i zasadowością – to samo, ale w jedną stronę zwiemy zasadowością, a w drugą kwasowością. A co by się stało, gdyby taki fluorowodór(+20 oC) wprowadzić do amoniaku (+10 oC)? Zauważmy, że dzieli je większa różnica kwasowości i zasadowości w porównania z wodą (pokój z 15 oC). Fluorowodór będzie jeszcze chętniej chętniej oddawał swój amoniakowi, niż czyni to w wodzie, bo dzieli je większa różnica kwasowości. I rzeczywiście, jeśli wprowadzimy do wodnego roztworu kwasu fluorowodorowego (czyli roztworu zawierającego H3O+) amoniak, to woda zrzuci z siebie to jarzmo, jakim jest dodatkowy proton, na amoniak, który ma mniejszą skłonność do oddawania swoich protonów, ale większą do przyjmowania. Z kolei ciekły H2S, poza wrednym zapachem, to także ma większe skłonności do oddawania protonu, niż woda, więc rozpuszczony w wodzie oddaje jej część swoich protonów, co czyni go kwasem. Zarówno H2S jak i HF chętniej będą oddawać swoje protony amoniakowi, niż wodzie, bo amoniak, jako słabszy kwas niż woda, nie będzie miał siły protestować.
A tak naprawdę woda jest kwasem, ale ma odczyn obojętny, co wynika z faktu, że KAŻDY czysty rozpuszczalnik dysocjuje na taką liczbę kationów i i taka liczbę anionów, że ich ładunek się wzajemnie zobojętnia (wyzerowuje). Obojętny odczyn ma skroplony amoniak, skroplony HCl – amoniak staje się zasadą dopiero wobec silniejszego od siebie kwasu, a chlorowodór wobec słabszego od siebie kwasu (silniejszej zasady). Woda ma obojętny odczyn, ale nie obojętny charakter. Dodatkowo przyjmujemy ją za punkt odniesienia – w końcu jest to najpowszechniejszy rozpuszczalnik na Ziemii i w którym przebiegają wszystkie procesy biochemiczne, i większość reakcji rozpatrywanych przez chemię nieorganiczną. Amoniak traktujemy jako zasadę patrząc na jego zachowanie w wodzie. Podobnie z kwasami, patrzymy jak zachowują się w wodzie. Patrząc dalej na kwasowość i zasadowość, to w połączeniach z wodorem weźmy np. grupy 15 i 16, to mamy wzrost kwasowości w dół grupy: NH3, PH3, AsH3, SbH3 BiH3 – amoniak jest najsilniejszą zasadą (co oznacza: najsłabszym kwasem) – BiH3 – najsłabszą zasadą (najsilniejszym kwasem). Podobnie w grupie 16: H2O, H2S, H2Se, H2Te – woda jest najsilniejszą zasadą (i najsłabszym kwasem), H2Te jest najsłabszą zasadą i najsilniejszym kwasem. Podobnie w następnej grupie od HF począwszy, najsilniejszej zasady (i najsłabszego kwasu) a na HI kończywszy. Gdyby najpowszechniejszym rozpuszczalnikiem na Ziemi był ciekły H2S (fuj!) to wodę byśmy traktowali jako zasadę, bo H2S byłby punktem odniesienia i byłby „obojętny”. Ale może istnieć inna planeta, gdzie oceany wypełnia ciekły siarkowodór i tam chemicy nieorganicy zaliczyli by zapewne wodę do zasad, a siarkowodór przyjęli by za punkt odniesienia. W końcu zobaczmy na te reakcje:

Jest to przecież ten sam typ reakcji – wyparcie wodoru z kwasu. Amoniak tak naprawdę powinno się zapisywać jako H3N i wtedy byśmy mieli wzór amidku sodu NaH2N co jest bliższe wzorowi soli. Powinniśmy zwrócić uwagę, że i w NaOH zapisujemy wodór z prawej strony, mimo że w cząsteczce wody zapisujemy go z lewej. Jednakże przyjęta konwencja zapisu w żaden sposób nie powinna nam przysłaniać właściwości chemicznych. Wypieranie wodoru można prowadzić dalej:
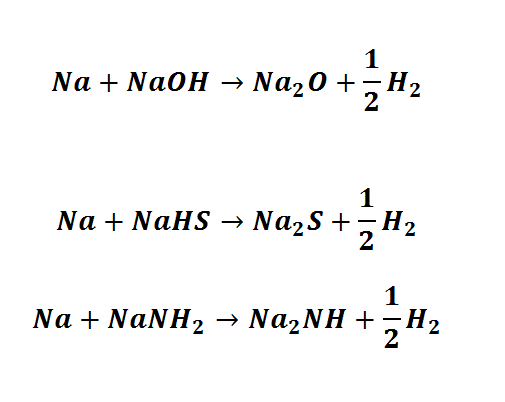
Zdajemy sobie sprawę, że kwasy są znacznie słabsze na drugim stopniu dysocjacji, niż na pierwszym – wyparcie drugiego atomu wodoru jest znacznie trudniejsze, a w przypadku wody – wymaga wręcz wysokich temperatur.
Właściwości kwasowe rosną w prawo w okresie: H2O jest silniejszym kwasem niż NH3 – w reakcji NaNH2 z H2O nastąpi tzw. hydroliza – czyli woda jako silniejszy kwas wyprze słabszy( NH3) z jego soli:

Z kolei NaOH w kontakcie HF – silniejszym kwasem od wody – utworzy nową sól i wodę, silniejszy kwas wyparł słabszy z jego soli.
Tak naprawdę wszystkie otrzymane w powyższych równaniach związki są solami odpowiednich kwasów, nawet NaOH. I wiem, że z punktu widzenia edukacji chemicznej, zwłaszcza szkolnej, burzy to cały porządek, ale tak jak pisałem, woda jest punktem odniesienia. Reakcja zobojętniania – wodorotlenku z kwasem – to tak naprawdę wyparcie słabego kwasu (H2O) z jego soli (wodorotlenku) przez mocniejszy kwas. A sole hydrolizują, bo woda próbuje dokazać, i wyrwać, co swoje, bowiem pomiędzy solą i kwasem zawsze ustala się równowaga, o czym pisałem w artykule o wypieraniu się kwasów. Gdyby woda była chemicznie obojętna – nie miałaby kwasowych właściwości – nie dysocjowała by. A sole słabych kwasów lub słabych zasad nie ulegały by hydrolizie w niej, bo nie byłyby dostępne ani protony, ani jony hydroksylowe, by takowa reakcja mogła zajść.
Reakcja tlenków metali z wodą to tak naprawdę tworzenie wodorosoli:
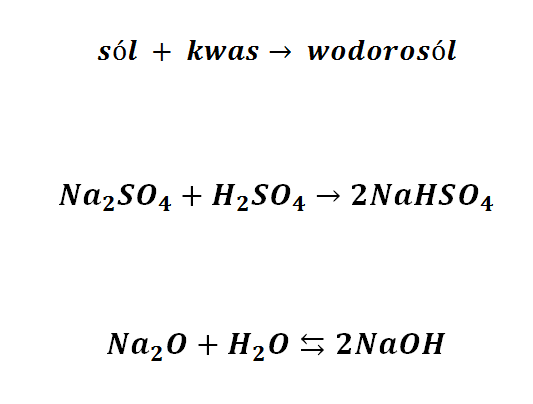
A alkoholany? Alkohole są słabszymi kwasami niż woda – ich sole ulegają w wodzie hydrolizie – wyparciu alkoholu przez wodę. Ponieważ woda jest kwasem, to nie każdą sól da się otrzymać w wodnym środowisku, bo są przypadki, że stopień hydrolizy wynosi blisko 100% (ot, chociażby alkoholany, ale także wiele soli nieorganicznych).
A skoro NaOH jest solą (wodorosolą), to dlaczego zaliczamy go do zasad? A dlatego, że za właściwości zasadowe odpowiadają aniony w solach – zasada zgodnie z przyjmowaną teorią Broensteda jest akceptorem protonu: OH–, NH2–, HS–, F–, NO3– itd, kwas zaś jego donorem: H2O, H2S, NH3, HF, HNO3. Takie alkoholany są solami, ale w reakcjach z ich użyciem wykorzystujemy ich właściwości zasadowe – właściwości anionu alkoksylowego RO–. Tak więc, mimo że to sole, możemy je traktować jako zasady organiczne i nikt się tego nie może przyczepić.
To tyle. Tak jak pisałem, tutaj na Ziemi – to zachowanie w wodzie określa to, czy coś klasyfikujemy jako kwas czy zasadę, ale nie zapominajmy, że tlen należy do układu okresowego – a tym rządzi prawo okresowości, że jego właściwości są pośrednie pomiędzy N a F. Przecież nie może być sytuacji, że posuwamy się po układzie okresowym – i nagle jest dziura, bo natrafiliśmy na tlen. woda zachowuje się jak kwas beztlenowy, tyle że ma pecha – atom tlenu, zamiast milej widzianej np. siarki, która leży w tym samym okresie. A wszelkie podziały i klasyfikacje mają charakter umowny i ułatwiają poruszanie się po związkach i ich reakcjach, ale pamiętajmy: „Do którejkolwiek włożysz mnie szufladki – nóżki zawsze będą mi z niej wystawać”.
Źródło obrazka: http://obrazki.4ever.eu/inne/wir-wodny-213647

Gratulacje!