Ruten wczoraj i dziś – od Śniadeckiego do Grubbsa
Historia odkrycia rutenu
Oficjalnym odkrywcą rutenu jest rosyjski uczony, Karl Ernst Klaus (1844). Nazwa pierwiastka pochodzi od łacińskiej nazwy Rosji: „Ruthenia”. Klaus dogłębnie zbadał właściwości chemiczne rutenu oraz wyznaczył jego masę atomową. Jednak sam ruten mógł zostać odkryty znacznie wcześniej.
Istnieje duże prawdopodobieństwo, że pierwszym odkrywcą rutenu był polski chemik, lekarz i filozof, Jędrzej Śniadecki. W 1808 napisał on pracę pt. „Rosprawa o nowym metallu w surowey platynie odkrytym”, a następnie na jej podstawie wygłosił wykład na Uniwersytecie Wileńskim. Praca Śniadeckiego dotyczyła analizy chemicznej samorodków platyny pod kątem poszukiwania nowych pierwiastków. Prócz czterech znanych wcześniej pierwiastków, towarzyszących platynie (Ir, Os, Pd, Rh), odkrył nowy, nieznany wcześniej metal, któremu nadał nazwę vestium, pochodzącą od nowoodkrytej planetoidy Westa. Wedle wszelkiego prawdopodobieństwa owym tajemniczym metalem był właśnie ruten.
O odkryciu nowego pierwiastka Śniadecki poinformował Instytut Francuski w Paryżu. Jego doświadczenie nie zostało jednak potwierdzone przez członków komisji, a tym samym polski uczony nie został uznany za odkrywcę rutenu. [1]
Właściwości rutenu

W układzie okresowym ruten umiejscowiony jest w bloku elektronowym d, grupie 8, okresie 5. Zaliczany jest do platynowców lekkich i wykazuje podobne do nich właściwości chemiczne. W przyrodzie występuje bardzo rzadko- pod względem rozpowszechnienia zajmuje 74. miejsce, a jego zawartość w skorupie ziemskiej nie przekracza 0,01 ppm. [2]
Ruten jest szarobiałym, lśniącym metalem, twardym i kruchym, łatwym do sproszkowania, o gęstości 12, 37 g. cm-3. Topi się w temperaturze 2607K. Aktywność chemiczna rutenu jest niewielka. Nie roztwarza się on w HCl, HNO3, ani w wodzie królewskiej. Po silnym ogrzaniu reaguje z tlenem, siarką, fosforem, fluorem i chlorem. W związkach występuje na różnych stopniach utleniania (od –II do VIII). Znane tlenki rutenu to lotny RuO4 o nieprzyjemnym zapachu (analogiczny do OsO4), a także RuO2. Podobnie jak inne platynowce, ma tendencję do tworzenia licznych związków kompleksowych. [3]
Zastosowania rutenu
Ruten znajduje liczne zastosowania m. in. jako składnik stopów specjalistycznych, cechujących się wysoką twardością i wytrzymałością oraz specyficznymi właściwościami elektrycznymi. [3]
Duże znaczenie we współczesnej chemii mają organiczne kompleksy rutenu. [1, 4]
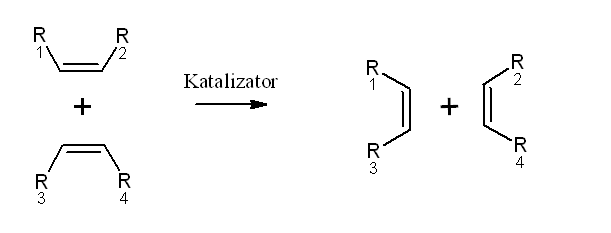
Katalizatory Grubbsa
Kompleksy przedstawione na rysunku są katalizatorami reakcji zwanej metatezą olefin (alkenów).
Użycie katalizatorów rutenowych umożliwiło wykorzystanie reakcji metatezy na szeroką skalę. Do zalet metatezy należy powstawanie niewielkich ilości produktów ubocznych i niebezpiecznych odpadów a także zmniejszenie liczby etapów wielu syntez.
Przykładowe zastosowania metatezy:
- synteza organiczna- m. in. synteza asymetryczna
- przemysł farmaceutyczny- produkcja leków
- produkcja polimerów:
– zabezpieczanie powłok skrzydeł samolotowych
– pokrycie płyt CD/DVD
– tworzywa sztuczne
- przemysł petrochemiczny- zwiększanie liczby oktanowej benzyny
Pierwszym rutenowym katalizatorem metatezy jest związek1.otrzymany przez R. Grubbsa. Następnie syntezowano katalizatory II generacji oraz katalizatoryHoveydy. Różnią się one trwałością, reaktywnością, kompatybilnością z różnymi grupami funkcyjnymi itd., zatem stosowane są w różnych rodzajach metatezy. [4, 5]
W roku 2005 Robert H. Grubbs, Richard R. Schrock oraz YvesChauvinuhonorowani zostali Nagrodą Nobla za badania nad reakcją metatezy olefin. [4]
Tris-(2,2’-bipirydylo)ruten(II)
Związek ten, w skrócie oznaczany jako Ru(bpy)32+ ,zasługuje na uwagę ze względu na swoje charakterystyczne właściwości optyczne. Ru(bpy)32+ pochłania światło w zakresie widzialnym oraz UV. Stan wzbudzony tego kompleksu charakteryzuje się długim czasem życia. Przy powrocie do stanu podstawowego emitowany jest foton o długości fali ok. 600 nm, co odpowiada światłu czerwonemu.
Ru(bpy)32+ jest stosowany jako katalizator fotoredoks. Po wzbudzeniu jest on silnym reduktorem
(E Ru(bpy)32+* / Ru(bpy)33+ = -0,86V). Z kolei forma utleniona kompleksu jest silnym utleniaczem
(E Ru(bpy)32+ / Ru(bpy)33+ = 1,26V). Ru(bpy)33+ utlenia wodę do tlenu cząsteczkowego i jonów OH–, co w przyszłości może być wykorzystane w ogniwach paliwowych.
Fotodegradacja ścieków
Ciekawym zastosowaniem bipirydynowych kompleksów rutenu może okazać się fotodegradacja zanieczyszczeń przemysłowych i ścieków, zawierających substancje toksyczne, np. pestycydy czy fenole.
Schemat działania prototypowego fotodetoksykatora ścieków opartego na Ru(bpy)3 2+ przedstawiony jest na rysunku obok.
Pod wpływem promieni słonecznych Ru(bpy)3 2+ osadzony na zeolicie ulega wzbudzeniu, a następnie utlenieniu przez rozpuszczony w wodzie tlen. Powstały Ru(bpy)3 3+ powoduje utlenienie zanieczyszczeń organicznych (np. fenoli, pestycydów), powracając do stanu zredukowanego. [6]

Ru(bpy)3 2+ wykorzystuje się w różnych metodach analitycznych, opartych na reakcjach fotoredoks. Jako przykład posłużyć może elektroluminescencyjny biosensor DNA.
Wykrywanie DNA metodą ECL (electrogeneratedchemiluminescence) ma wiele zalet, m.in. nie wykorzystuje radioizotopów, posiada bardzo wysoką czułość, a pomiar jest szybki, prosty i łatwo go zautomatyzować.
Opisana metoda pozwala na wykrywanie DNA zhybrydyzowanego (dwóch nici połączonych zgodnie z zasadą komplementarności).
Proces detekcji DNA metodą ECL przebiega następująco:
- Na powierzchni elektrody pracującej immobilizowane są nici ssDNA (DNA jednoniciowe)
- Następuje hybrydyzacja DNA (łączenie się nici DNA, zgodnie z zasadą komplementarności)
- Pomiędzy kolejne pary zasad azotowych DNA wprowadzana jest płaska cząsteczka interkalatora, np. DAPI (4’, 6-diamidyno-2-fenyloindol)
- Ru(bpy)3 2+ utleniany jest na elektrodzie pracującej do Ru(bpy)3 3+
- Ru(bpy)3 3+ utleniainterkalator, redukując się do Ru(bpy)3 2+* (stan wzbudzony)
- Ru(bpy)3 2+* powraca do stanu podstawowego, emitując kwanty światła o długości fali ok. 620 nm, odpowiadającej światłu czerwonemu. Intensywność światła jest proporcjonalna do ilości zhybrydyzowanego DNA
- Detektor mierzy intensywność światła i na tej podstawie określa ilość zhybrydyzowanego DNA
Ponieważ metoda tą wykrywane jest jedynie DNA zhybrydyzowane, jest ona użyteczna do określania stopnia podobieństwa sekwencji łańcuchów DNA pobranych z dwóch różnych komórek (w obrębie niekomplementarnych zasad azotowych hybrydyzacja nie zajdzie). Na tej podstawie możliwe jest np. wyznaczenie stopnia pokrewieństwa gatunkowego (jeżeli zmiesza się DNA pochodzące od dwóch różnych gatunków).
Za pomocą Ru(bpy)3 2+ możliwe jest także oznaczanie szczawianów, NADH i wielu innych związków. Różne modyfikacje techniki ECL pozwalają na wykrywanie uszkodzeń materiału genetycznego, przeprowadzanie testów immunologicznych czy rozpoznawanie komórek nowotworowych. [7, 8]
Laureaci Nagrody Nobla w dziedzinie chemii w roku 2005
YvesChauvin(ur. 10 października 1930, Belgia) – francuski chemik, dyrektor Francuskiego Instytutu Naftowego oraz członek Francuskiej Akademii Nauk.Prowadził badania nad mechanizmem reakcji metatezy.
Robert Howard Grubbs(ur. 27 lutego 1942, USA) – amerykański chemik.
Ukończył studia z zakresu chemii na University of Florida w Gainesville oraz w Columbia University w Nowym Jorku.Profesor Grubbs opracował katalizatory, do reakcji metatezy, które są kompleksami metaloorganicznymi rutenu.
Richard RoyceSchrock(ur. 4 stycznia 1945, USA)
Zajmuje stanowisko profesora Massachusetts Institute of Technology. Opracował on katalizatory do reakcji metatezy, które są kompleksami metaloorganicznymi molibdenu i wolframu.
Jędrzej Śniadecki
Urodzony w 1768. Pochodził z zamożnej rodziny na Kujawach. Młodszy brat Jana Śniadeckiego- profesora matematyki i astronomii w Szkole Głównej w Krakowie oraz działacza Komisji Edukacji Narodowej.
Jędrzej Śniadecki był człowiekiem wszechstronnie wykształconym- studiował na uniwersytetach w Krakowie, Padwie, Birmingham oraz Wiedniu. Piastował urząd profesora na Uniwersytecie Wileńskim, gdzie prowadził przede wszystkim badania chemiczne.
Uważany jest za jedną z najwybitniejszych postaci polskiego oświecenia. Nazywany ojcem chemii polskiej. Opracował podstawy polskiej nomenklatury chemicznej oraz napisał „Początki chemii”, która to książka była pierwszym polskim podręcznikiem chemicznym. Oprócz chemii zajmował się biologią, medycyną, farmacja, filozofią i literaturą. Zmarł w roku 1768. [1]
Bibliografia
- Wiedza i Życie 2/2011, wyd. Prószyński Media
- A. Bielański- Podstawy chemii nieorganicznej, Wydawnictwo Naukowe PWN. Warszawa 2008
- D. L. Heiserman- Księga pierwiastków chemicznych wyd. Prószyński i S-ka, Warszawa 1997
- Ł. Gułajski- Próby opracowania syntezy wybranych katalizatorów typu Hoveydy-Grubbsa potencjalnie użytecznych w reakcji polimeryzacji, Warszawa 2006
- M. Tryznowski-Zastosowanie kompleksowych związków rutenu osadzonych na nośniku polimerowym, jako katalizatorów metatezy olefin–praca magisterska, Warszawa 2003
- W. Szubiński- Opracowanie zeolitowych oraz polprzewodnikowych katalizatorów fotodegradacji wód oraz ścieków, Katowice 2006
- 7. Z. Changa, J. Zhoua, K. Zhaoa, N. Zhuc, P. Hea, Y. Fang- Ru(bpy)32+ -doped silica nanoparticle DNA probe for the electrogeneratedchemiluminescence detection of DNA hybridization, Science Direct, 2006
- Bioelectrochemistry70 (2007) 228–234
Wykorzystane grafiki:
http://www.zdziabek.pl/Podstrony/Polacy%20XIX/03.jpg
http://commons.wikimedia.org/wiki/File:Ru1_modi.jpg
http://upload.wikimedia.org/wikipedia/commons/thumb/8/8f/Tris%28bipyridine%29ruthenium%28II%29_chloride.png/800px-Tris%28bipyridine%29ruthenium%28II%29_chloride.png
http://images.nobelprize.org/nobel_prizes/chemistry/laureates/2005/chauvin_postcard.jpg
http://upload.wikimedia.org/wikipedia/commons/b/b1/Robert_H._Grubbs_portrait-2.jpg
http://images.nobelprize.org/nobel_prizes/chemistry/laureates/2005/schrock_postcard.jpg
Wzory strukturalne, schematy reakcji i procesów są własnością autora.
Praca konkursowa zgłoszona przez użytkownika: Alderon.
Wszelkie ilustracje są dostępne w dwóch wersjach (mała i duża)
ruthenium(II)-chloride-powder.jpg)
ruthenium(II)_chloride.png)