Sole – związki jonowe?
Sole – związki chemiczne, o których uczymy się od najwcześniejszego etapu szkolnej nauki chemii. Wydawać by się mogło, że o solach wiemy wszystko, co wiedzieć powinniśmy po przeciętnym kursie chemii. Jeszcze więcej powinniśmy wiedzieć po rozszerzonym kursie, albo po studiach i temat powinien być wręcz wyczerpany. Jednakże przyglądając się bliżej solom – zauważymy, gdzie padliśmy ofiarą zbytniego generalizowania, a gdzie – zostaliśmy wręcz okłamani przez edukację. Oczywiście zdajemy sobie sprawę, że edukacja zawsze będzie podlegać pewnym ograniczeniom i uproszczeniom, ale czy zawsze należy się ich bezkrytycznie trzymać? Spróbujemy poruszyć kilka zagadnień, które rzucą nowe światło na kwestię budowy i charakteru wiązań w solach.
Czym są sole?
Metod otrzymywania soli jest wiele, ale definicja zakłada, że są takie związki, które są produktami reakcji kwasu z zasadą, gdzie część lub wszystkie atomy wodoru zostały zastąpione kationami metali, lub innymi kationami o bardzie złożonej budowie – sole mają budowę jonową, jak nieraz lubimy się dowiadywać w szkole. Często dowiadujemy się też, że wszystkie sole są w roztworach wodnych całkowicie zdysocjowane, czyli mocnymi elektrolitami, a ze względu na jonową budowę – mają bardzo wysokie temperatury topnienia, nawet przy niskiej masie cząsteczkowej. Z czasem dowiaduje się także, że sole dzielimy na pojedyncze, podwójne i wielokrotne, oraz na sole proste i sole kompleksowe (złożone). Rozpatrzymy kilka kwestii, które dadzą nam do myślenia nad zgodnością rzeczywistości z wynoszonymi ze szkoły informacjami o solach.
1. Chlorki metali aktywnych
Niemal codziennie większość z nas styka się z chlorkiem sodu NaCl. Związek ten ma słony smak. Jednakże słony smak mają też inne chlorki: KCl, MgCl2 czy CaCl2. Temperatury topnienia tych związków kształtują się następująco:

Jak na razie wszystko pasuje: zgodne z tym, czego oczekujemy po związku o budowie jonowej: wysokie temperatury topnienia, a podobny smak wynika z faktu, że wszystkie zawierają anion chlorkowy, odpowiadający za ten smak.
2. Jaki kolor mają sole miedzi(II) i ich wodne roztwory?
Gdyby przeprowadzić ankietę, to większość zarówno chemików, nauczycieli chemii jak i uczniów odpowie, że bezwodne sole miedzi są białe, a uwodnione – niebieskie, powołując się na CuSO4, który jest biały, ale już po uwodnieniu staje się niebieski (CuSO4*5H2O) i po rozpuszczeniu w wodzie daje niebieskie roztwory. O tym zresztą, że uwodnione sole miedzi są niebieskie, a bezwodne białe, dowiadujemy się w szkole. Przyjrzyjmy się jednak kolorom związków miedzi, z których wszystkie wg tradycyjnej klasyfikacji zaliczamy do soli:

Wszystkie wymienione związki łatwo rozpuszczają się w wodzie. Zauważmy jednak, że kolor niebieski, do którego przywykliśmy, wcale nie jest taki oczywisty, jakbyśmy się mogli spodziewać, zwłaszcza w przypadku halogenków miedzi. Roztwory siarczanu(VI) miedzi w wodzie są niebieskie dzięki obecności kompleksowego jonu [Cu(H2O)4]2+. Izolowane jony Cu2+ jak i SO42- nie mają barwy, ale obecność wody powoduje, że układ przyjmuje niebieską barwę właśnie przez powstanie kompleksowego jonu miedzi. Rozcieńczając lub zatężając roztwór CuSO4 nie powodujemy zmiany barwy, a jedynie zmianę intensywności tej samej barwy. Ale jaki kolor ma roztwór chlorku miedzi? Ci, którzy mieli okazję sporządzać roztwór tego związku w wodzie zaiste wiedzą, że roztwory tego związku nie mają jednej barwy: stężone roztwory są intensywnie zielone, a gdy są rozcieńczane to stopniowo przechodzą w niebieskie. Jeszcze ciekawiej sytuacja ma się w przypadku roztworów bromku miedzi(II), które od brunatnych przez zielone przechodzą w niebieskie. Z czym to jest związane?
3. Jaki kolor mają sole Fe(II), Fe(III) i ich wodne roztwory?
Sytuacja wręcz analogiczna do poprzedniej. Jedną z rzeczy, którą muszą pamiętać maturzyści, to barwa roztworów soli żelaza(II) i soli żelaza(III). I gdyby tak spytać maturzystę, to wyrecytuje, że barwa roztworów zawierających jon Fe2+, lub ściślej [Fe(H2O)6]2+ jest zielona, z kolei barwa roztworów Fe3+, czyli bardziej [Fe(H2O)6]3+ jest brunatna w wyższym, a żółtawa w niskim stężeniu. Najpospolitszą solą żelaza(III) jest FeCl3, który łatwo tworzy hydrat FeCl3*6H2O. Bezwodny związek jest niemal czarny, podczas gdy uwodniony – jest żółtobrunatny, lub czasem spotyka się stwierdzenie, że pomarańczowy, jednakże pomiędzy pomarańczowym K2Cr2O7 a „pomarańczowym” FeCl3*6H2O jest tak duża różnica, że zdecydowanie lepiej nazwać go żółtobrunatnym, niż pomarańczowym. Jak już wspomniałem, uczniowie muszą pamiętać, że roztwory Fe3+ są brunatne, ale przeważnie nie mają świadomości tego, że barwa ta dotyczy zasadniczo roztworów FeCl3. A jak ma się sprawa z innymi solami żelaza(III)? Spójrzmy na tabelę 3.

I tutaj musimy sobie zadać kolejne pytanie: Dlaczego kolor uwodnionych soli: siarczanu i azotanu żelaza jest fioletowy, a reszty inny? Jak to się ma do szkolnej wersji powtarzanej od lat, że w roztworach wodnych jony Fe2+ mają barwę zieloną, a Fe3+ – brunatnożółtą? Można tutaj argumentować: przecież barwa soli to nie tylko barwa kationu, ale także barwa anionu. Kationy metali w roztworach wodnych mają zabarwienie wtedy, gdy mają niezapełnioną podpowłokę d, której pojemność wynosi 10 elektronów. Stąd też kation cynku ([Ar]3d10) jest bezbarwny, podczas gdy kationy żelaza ([Ar]3d5 lub [Ar]3d6) czy miedzi(II) ([Ar]3d9) – w roztworach wodnych nie są bezbarwne. Bezbarwne są kationy metali pierwszej i drugiej grupy. Jednakże skoro zarówno chlorek jak i bromek sodu są bezbarwne, to i anion chlorkowy i bromkowy także muszą być bezbarwne. Dlaczego więc w przypadku związków Fe(III) wymianie bezbarwnego anionu Cl– na bezbarwny Br– towarzyszy zmiana barwy? Oba związki powinny mieć tę samą barwę wynikającą z barwy kationu – a jednak tak nie jest. Co więcej, to przecież roztwory tych związków powinny mieć barwę jasnofioletową, bo przecież w roztworze powinny być jony Fe3+, a ściślej [Fe(H2O)6]3+ powstałe w wyniku całkowitej dysocjacji FeCl3 czy FeBr3, bo sole to, jak nas uczą, mocne elektrolity (całkowicie zdysocjowane), a aniony chlorkowe i bromkowe nie powinny wpływać na barwę roztworów.
4. W czym rozpuszczają się sole?
Pierwsze skojarzenie wyniesione ze szkoły, to zaiste woda, bo jest polarna. Jednakże poza polarnymi rozpuszczalnikami jak woda, czy sulfotlenek dimetylu są i rozpuszczalniki o niższej polarności: alkohole, etery, ketony, estry i inne. Jeśli zadamy chlorek sodu acetonem czy izopropanolem, to się okaże, że prawie nic się nie rozpuściło, a siarczan sodu czy magnezu są środkami suszącymi stosowanym do usuwania wody z układów, w których te sole się praktycznie nie rozpuszczają – np. octan etylu możemy osuszyć bezwodnym siarczanem sodu, który ulega uwodnieniu do aż do Na2SO4*10H2O. Gdy jednak nasz poczciwy, żółty CuCl2, lub zielony CuCl2*2H2O zadamy np. izopropanolem, to możemy być zaskoczeni, bo okaże się, że sól ta rozpuszcza się w nim bardzo dobrze, niemal tak samo jak w wodzie! A tymczasem równie poczciwy chlorek sodu jest w nim praktycznie nierozpuszczalny i możemy alkoholami wytrącać go z wodnych roztworów. Jakby tego było mało, to okaże się, że wiele soli metali bloku d i p – dobrze rozpuszcza się nawet w eterach i ketonach czy estrach i nitrylach, podczas gdy sole metali bloku s – są w nich praktycznie nierozpuszczalne. Wyjątkiem są tutaj związki berylu, które zachowują się podobnie jak sole metali bloku d i p.
5. Rozpuszczalność hydratów, a rozpuszczalność soli bezwodnych
Chlorek glinu AlCl3, a właściwie Al2Cl6 – bezwodny rozpuszcza się nie tylko w wodzie, ale także w takich rozpuszczalnikach, jak eter dietylowy czy niepolarny tetrachlorek węgla. Tymczasem jego hydrat AlCl3*6H2O – jest w tych rozpuszczalnikach praktycznie nierozpuszczalny. Pikanterii sprawie dodaje fakt, że SnCl4 miesza się w każdym stosunku z takimi cieczami jak CS2 czy CCl4! A uwodniony – jest w nich praktycznie nierozpuszczalny. Spotka nas jeszcze więcej niespodzianek, gdy przyjrzeć się rozpuszczalności wielu soli w układach niewodnych. Liczne sole tworzą hydraty, jednakże zachowanie soli bezwodnej potrafi być w wielu przypadkach diametralnie różne od hydratu: ot, bezwodna sól może się rozpuszczać w ketonie, podczas gdy już hydrat – być praktycznie nierozpuszczalny w tym samym rozpuszczalniku. Skąd to wynikają tak wielkie różnice?
6. Jaką temperaturę topnienia mają sole?
Spodziewamy się, że wysoką… Tak by wynikało, po raz kolejny, z wiadomości, które zostały nam przekazane w szkole. Wiemy też, że na temperaturę topnienia ma wpływ m.i. masa cząsteczkowa (choć masa „cząsteczkowa” w ujęciu do związków jonowych jest mało trafnym określeniem). Przyjrzyjmy się temperaturom topnienia soli o porównywalnej masie cząsteczkowej:

A zatem zauważamy, że wśród połączeń zaledwie dwóch pierwiastków – soli kwasów beztlenowych – istnieją ciecze w temperaturze pokojowej. Dlaczego?
7. Chlorek chromu(III) – chemiczny kameleon. Izomeria wśród soli.
Chlorek chromu(III) to ciekawy przypadek. Postać uwodniona to CrCl3*6H2O. Jednakże związek ten można otrzymać w trzech wersjach barwy: ciemnozielonej, jasnozielonej i fioletowej. Pytanie: dlaczego? Wynika to z faktu, że pod wzorem sumarycznym CrCl3*6H2O mogą kryć się aż 3 izomery: [Cr(H2O)6]Cl3 o barwie fioletowej, [Cr(H2O)5Cl]Cl2*H2O o barwie jasnozielonej i [Cr(H2O)4Cl2]Cl*2H2O o barwie ciemnozielonej. Jak to się dzieje, że możemy mieć do czynienia z izomerią wśród soli?
8. Dlaczego Al2Cl6, a nie AlCl3. Reguła helowca.
Przyjrzyjmy się jeszcze raz chlorkowi glinu. Z przyzwyczajenia zapisujemy jego wzór jako AlCl3, ale nie jest to jego wzór rzeczywisty, tylko empiryczny. Jego rzeczywisty wzór to Al2Cl6. Chlorek glinu jest dimerem, zaś dimeryzacja jest typowym zjawiskiem wśród związków pierwiastków grupy 13. Dimeryzują nawet borowodory. Zadajmy sobie więc pytanie, dlaczego chlorek glinu dimeryzuje? Co sprawia, że bezwodny związek można łatwo oczyszczać przez sublimację? Wolny atom glinu ma 3 elektrony walencyjne: 3s23p1. Gdy je odda – otrzymamy kation Al3+, o konfiguracji neonu. Ale drugą możliwością jest konfiguracja argonu. Jak uzyskać jego konfigurację? Przyjąć elektrony: utworzyć 3 wiązania przez uwspólnienie swoich 3 elektronów walencyjnych, a do oktetu wykorzystać jedną z wolnych par elektronowych atomu chloru. W przypadku chlorku glinu powstają dwa mostki chlorkowe Al-Cl-Al i mamy do czynienia z dimerem. Glin uzyskuje dzięki temu konfigurację argonu.

Najbliższym sąsiadem glinu w układzie okresowym jest beryl. Sytuacja jest jeszcze ciekawsza, gdy przyjrzymy się związkom tego metalu, który może uwspólnić tylko dwa elektrony. Jak więc ma osiągnąć konfigurację helowca? Musi utworzyć aż dwa wiązania koordynacyjne, np. z chlorem czy jodem. Związki berylu mogą tworzyć polimeryczne łańcuchy, jak widzimy poniżej.

A co się stanie, gdybyśmy przypisali hybrydyzację atomowi centralnemu w przypadku BeCl2? Dobrze przygotowani maturzyści ustalą, że atomem centralnym jest atom berylu i przypiszą mu hybrydyzacje sp. Ale – skoro beryl tworzy nie dwa, a aż 4 wiązania, to mamy tutaj do czynienia z układem tetraedrycznym i prawidłowy model to nie sp, a sp3! Podobnie w przypadku chlorku glinu tradycyjnie podręczniki mówią o sp2, a poprawna odpowiedź to sp3. A do tego BeCl2 czy BeI2 to wzory empiryczne, bo rzeczywiste to BenCl2n lub (BeCl2)n.
9. Lżejszy, a zachowuje się jak cięższy
Wspomniałem już o rozpuszczalności chlorku cyny(IV). Cyna tworzy dwa chlorki: SnCl2 i SnCl4. Z kolei tytan i żelazo tworzą po dwa chlorki: TiCl3 i TiCl4 oraz FeCl2 i FeCl3. Powinniśmy oczekiwać w parach, że wyższą temperaturę topnienia jak i wrzenia będą mieć chlorki na wyższych stopniach utleniania metalu, bo są cięższe, a jak wiemy, to wzrost masy molowej (cząsteczkowej?) wpływa na temperaturę topnienia i wrzenia związków – wyższa masa to wyższe temperatury zmiany stanu skupienia. Przyjrzyjmy się więc, jakie są temperatury przejść fazowych wspomnianych związków:

10. Przypadek WF6 – fluorku wolframu(VI)
Jest to przypadek, o którym chcę wspomnieć celowo. Związek metalu i niemetalu, ale czy jest to sól? W temperaturze standardowej (25 ℃) jest to najcięższy znany gaz. Czy jednak jest to sól? Czy sól może mieć gazowy stan skupienia w temperaturze, w której zwykle przebywamy? Zadajmy sobie inne pytanie: czy związek ten można otrzymać w reakcji kwasowo-zasadowej? Nie. Można go otrzymać w reakcji pierwiastków ze sobą. O ile AlCl3 czy BeCl2 można otrzymać w reakcji wodorotlenku odpowiedniego metalu z kwasem solnym, o tyle nie w przypadku WF6 czy WCl6. Nie istnieje bowiem W(OH)6, który ulegałby takowej reakcji, a WO3 – także nie chce reagować z kwasami, gdyż jest tlenkiem kwasowym. WF6 ulega hydrolizie w kontakcie z wodą aż do WO3. Czy więc związek ten jest solą? Chyba większość zgodzi się ze mną, że nie. Istnieją takie związki metali z niemetalami, które solami nie są.
Pauling, van der Walls i rentgenografia strukturalna: związki jonowe i kowalencyjne
Do jonowych zaliczamy te związki, w których występuje co najmniej jedno wiązanie jonowe. Np. w octanie sodu CH3COONa mamy 6 wiązań kowalencyjnych i jedno jonowe: kation Na+ oddziałuje elektrostatycznie z anionem CH3COO–. Ale jak mieliśmy okazję się przekonać, pospolite sole – nie zachowują się tak, jak zwykle byśmy od nich oczekiwali, bo wskazane przykłady kłócą się z tym, czego się spodziewamy od jonowych związków. W szkolnym ujęciu do określania charakteru wiązania służy skala elektroujemności zaproponowana przez Linusa Paulinga w 1932 roku, a więc blisko 100 temu! Skala ta tak silnie wtarła się w ludzką mentalność, że wielu chemików używa słowa elektroujemność jako jej synonimu. A to nie jest to samo, podobnie jak temperatura i skala Celsjusza to nie synonimy. Są różne skale elektroujemności, każda oparta na innych założeniach i niezupełnie się ze sobą pokrywają. Powszechnie przyjmuje się, że wiązanie ma charakter jonowy, jeśli wg skali Paulinga różnica elektroujemności wiążących się atomów przekracza 1,7. Ale! Jako najstarsza i najprostsza skala ta ma swoje ograniczenia i jest zawodna. Nie uwzględnia wszystkich czynników wpływających na charakter wiązania, jak krotność wiązania czy konfiguracja elektronowa pierwiastka w danym związku. Innym często stosowanym kryterium szkolnym jest założenie, że wiązanie jonowe powstaje wtedy, gdy metal wiąże się z niemetalem. Zanim przejdziemy dalej, musimy sobie uzmysłowić, że świat nie jest zero-jedynkowy. Póki nie rozpatrujemy związków kompleksowych (o czym za moment), to czysto jonowe wiązania zasadniczo nie istnieją. Pojęcie to jest modelowe, podobnie jak modelowym pojęciem jest gaz doskonały. Gazy rzeczywiste zachowują się bardzo podobnie do niego w pewnym zakresie ciśnienia i temperatury. W końcu tacy naukowcy jak Gay Lussac, Boyle, Charles czy Avogadro eksperymentowali z gazami rzeczywistymi (przede wszystkim z powietrzem) i na podstawie jego zachowania wprowadzili modelowe pojęcie gazu doskonałego. W idealnie jonowej strukturze wyróżniamy atomy, z których jedne mają ładunki dodatnie, a drugie ujemne, a pomiędzy nimi można wskazać wyraźną przerwę. Nie można wskazać, pomiędzy którymi atomami w sieci krystalicznej tworzy się wiązanie (to, które oznaczamy kreską). W idealnym krysztale jonowym atomy mają ładunki elektryczne całkowite (np. 2+, 2-), a pomiędzy nimi istnieje przerwa – obszar zerowej gęstości elektronowej. W układach rzeczywistych atomy nie są aż tak idealnie rozdzielone, co powoduje, że wartości ładunków elektrycznych nieco odbiegają liczb całkowitych, gdyż możliwy jest ruch elektronu ze sfery walencyjnej anionu do sfery walencyjnej kationu, co w skali makro powoduje, że średni ładunek kationu i anionu jest niższy od liczb całkowitych. Oczywiście musimy pamiętać, że ten ruch jest nieznaczny. W układach rzeczywistych do związków jonowych zaliczamy te związki, których budowę, z niewielkim błędem, można opisać przez idealny kryształ jonowy, podobnie jak wszystkie gazy można opisać równaniem stanu gazu doskonałego (ale w pewnym zakresie warunków ciśnienia i temperatury). Skoro skala Paulinga bywa zawodna, to jak rozpoznać, co zaliczyć do związków jonowych, a co nie? O charakterze wiązania decyduje jego długość – odległość pomiędzy jądrami wiążących się atomów. Gdy jest ona niezbyt duża – na tyle mała, że sfery walencyjne mogą się efektywnie nakładać – mamy do czynienia z wiązania kowalencyjnymi, a pomiędzy jądrami wiążących się atomów znajdują się elektrony wiążące (mówimy o gęstości elektronowej, która jest większa przy jądrze bardziej elektroujemnego atomu, bo ten silniej ściąga do siebie wiążącą parę elektronową). Ale gdy odległość pomiędzy jądrami jest na tyle duża, że sfery walencyjne nie mogą się odpowiednio nakładać, to można wskazać wyraźną granicę pomiędzy wiążącymi się atomami – pomiędzy nimi można wykryć wyraźną przerwę – gęstość elektronowa jest niemal zerowa (a w idealnym krysztale jonowym – jest równa zeru). Rentgenografia strukturalna dostarcza nam informacji o tym, że w krysztale NaCl każdy kation sodu jest otoczony 6 anionami chlorkowymi – wszystkie znajdują się w tej samej odległości od atomu sodu. Podobnie anion chlorkowy otoczony jest 6 kationami sodu – wszystkie są w tej samej odległości, co przedstawia rysunek poniżej:

UWAGA! Kresek na powyższym rysunku nie należy mylić z wiązaniami!
W przypadku kryształu chlorku cezu CsCl każdy kation jest otoczony aż 8 anionami chlorkowymi. Ale nie jesteśmy w stanie wskazać, który wiąże się z którym – po prostu ładunki ujemne i dodatnie się wzajemnie przyciągają i stają się swoimi własnymi więźniami, jednocześnie sprawiając, że kryształ trzyma się kupy. Właśnie takie oddziaływanie elektrostatyczne nazywamy wiązaniem jonowym. Praktyka pokazała, że jonowe połączenia pomiędzy sobą tworzą przede wszystkim duże atomy, a o jonowości wiązania mówimy wtedy, gdy jego długość przekracza sumę promieni van der Waalsa. Promień va der Waalsa to odległość od jądra atomu do najdalej krążących elektronów, przy czym w przypadku jonów promień ten nazywamy promieniem jonowym, zatem w przypadku jonów są to promienie atomów, które oddały elektrony oraz promienie atomów, które przyjęły elektrony. Jeśli długość wiązania przekracza sumę promieni van der Wallsa, to oznacza, że pomiędzy atomami istnieje przerwa (niemal zerowa gęstość elektronowa), a układ jest scalany przede wszystkim dzięki oddziaływaniom elektrostatycznym (kulombowskim). Atom berylu – do gigantów nie należy – chętnie tworzy kowalencyjne wiązania, podczas gdy np. jego sąsiedzi z bloku, ale mieszkający 5 pięter niżej, czyli Cs i Ba – jako znacznie tęższych rozmiarów – chętniej tworzą połączenia jonowe. Typowe jonowe połączenia obserwujemy przede wszystkim w tych związkach prostych, w których mamy do czynienia z aktywnymi metalami, zwłaszcza o dużych rozmiarach atomów, z aktywnymi niemetalami. W takich przypadkach jak NaCl, KI, KF, CsBr, BaCl2, Sr(NO3)2 czy BaSO4 – mówimy o budowie jonowej. Ale nie można generalizować, że model jonowy opisuje budowę wszystkich soli. Co jeszcze warto brać pod uwagę, to fakt, że im bardziej dopasowane są do siebie kationy z anionami, to tym trwalszą sieć krystaliczną tworzą i tym trudniej ją rozbić cząsteczkom rozpuszczalnika. Dlatego też nie wszystkie jonowe związki dobrze rozpuszczają się w polarnych rozpuszczalnikach, jak wspomniany BaSO4.
Dysocjacja elektrolityczna
W krysztale jony mają bardzo ograniczone możliwości ruchu, co kłóci się z ich nazwą, która pochodzi z greckiego ionos, co oznacza wędrowiec. Trudno o to, by jony przemierzały sieć krystaliczną, ale na pewnym etapie edukacji każdy słyszał o wędrówce jonów w roztworze do odpowiednich elektrod. Przejdźmy jednak do rzeczy. Dysocjacją elektrolityczną nazywamy rozpad związków na jony. Można powiedzieć, że związki jonowe są „zdysocjowane z natury” – bo istnieje przerwa pomiędzy wiążącymi się atomami i składają się z kationów i anionów. Ale zdolność do dysocjacji elektrolitycznej posiadają także wiązania kowalencyjne spolaryzowane. Jednak co tak naprawdę nazywamy dysocjacją? Pamiętajmy, że jony o przeciwnych znakach się przyciągają – gdyby rozpuścić w wodzie chlorek sodu NaCl, a ten nie ulegałby dysocjacji elektrolitycznej, to ze względu na przyciąganie się jonów o przeciwnych znakach w roztworze byłyby pary jonowe: Na+Cl–. Nie należy par jonowych mylić z cząsteczkami NaCl! Cząsteczki rozpuszczalnika takiego, jakim jest woda, uniemożliwiają jonom kontakt ze sobą, bo tworzą otoczkę solwatacyjną wokół jonu i ekranują oddziaływania z innymi jonami – uniemożliwiają utworzenie jonom różnoimiennym par. Więc mimo, że związki jonowe zbudowane są z jonów, to jednak o ich dysocjacji elektrolitycznej mówimy wtedy, gdy jony o przeciwnych znakach są od siebie rozdzielone i mogą się poruszać – taki stan możliwy jest albo w roztworze, albo po stopieniu. W wodzie związki jonowe są całkowicie zdysocjowane. Z kolei związki kowalencyjne mogą być niemal całkowicie zdysocjowane (jak HCl w rozcieńczonych roztworach wodnych), lecz oczywiście nie muszą (jak CH3COOH w wodzie). A jak jest z solami? Czy wszystkie są w wodzie całkowicie zdysocjowane? Podręczniki nieraz twierdzą, że tak, bo to związki jonowe. Nie jest to prawdziwa informacja – wszystkie poruszone wcześniej aspekty kwestionują jonową naturę wielu soli, jak i całkowitą dysocjację w roztworach wodnych. Z tego też powodu barwa wielu roztworów zależy od stężenia (i stopnia dysocjacji).
Jaka jest budowa soli?
Ponieważ nie ma co dalej rozważać budowy soli metali pierwszej grupy, to przyjrzymy się budowie przykładowych soli metali bloku p i d, oraz berylu. W wielu przypadkach stwierdzono występowanie mostków czy to halogenkowych, czy to tlenkowych (cząsteczki wody). Przyjrzyjmy się tabeli, która przedstawia budowę przykładowych soli.
Chlorek glinu:
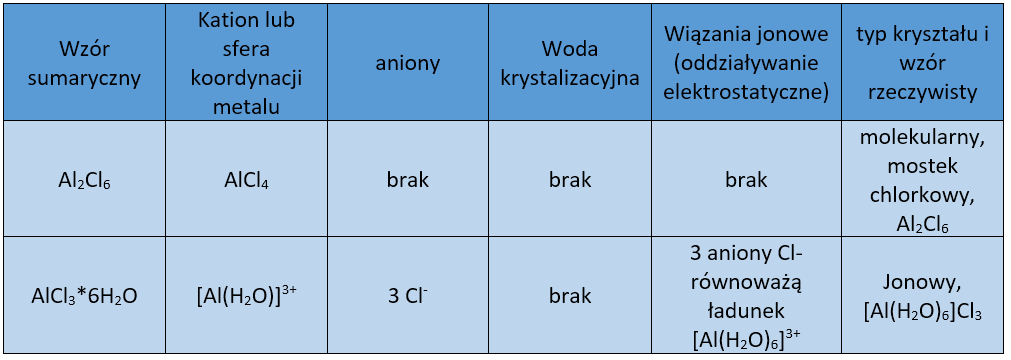
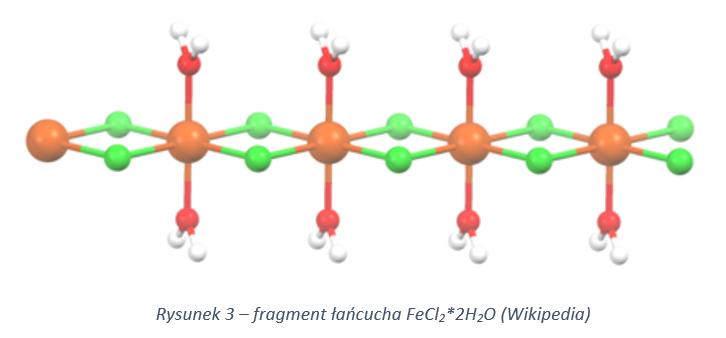
Chlorki żelaza:


Przyjrzyjmy się budowie trzech uwodnionych chlorków chromu(III).

Zauważmy, że izomery te różnią się tym, że woda i aniony chlorkowe częściowo wymieniają się miejscami. Nie przypadkiem też pierwszy z nich ma fioletowy kolor – zawiera ten sam kation (akwakompleks), co np. fioletowy Cr2(SO4)3*18H2O, którego rzeczywisty wzór to [Cr(H2O)6]2(SO4)3*6H2O. Tylko w fioletowym chlorku chrom wiąże się wyłącznie jonowo z chlorem.
Poszukamy jednakże odpowiedzi na kwestie poruszone wcześniej.
Ad 1) Chlorki metali aktywnych. Jak wynika z tabeli 1 – NaCl czy KCl – zachowują się tak, jak tego od związków jonowych oczekujemy. Ale już dalej – mamy coraz większe wątpliwości – z każdym następnym aspektem. Jak wyjaśnić barwy związków? Jak wyjaśnić odmiennie zachowanie się hydratów i soli bezwodnych? Jak wyjaśnić istnienie izomerów? Jak wyjaśnić dimeryzację związków pierwiastków grupy 13-stej?
Ad 2 i 3) Kolory związków miedzi i żelaza. Zachowanie się CuCl2, FeCl3, FeBr3 i części innych wspomnianych soli wyklucza się z jonowym charakterem tych związków i świadczy o rosnącym stopniu dysocjacji wraz z rozcieńczaniem roztworu.
Ad 4) W czym rozpuszczają się sole? Siarczan(VI) sodu ma właściwości typowe dla związku jonowego, podczas gdy CuCl2*2H2O – już nie.
Ad 5) Rozpuszczalność hydratów, a rozpuszczalność soli bezwodnych. Bezwodny chlorek glinu tworzy dimeryczne cząsteczki (budowa kowalencyjna), podczas gdy uwodniony AlCl3*6H2O to w istocie [Al(H2O)6]Cl3, związek zbudowany z kompleksowych kationów [Al(H2O)6]3+ i 3 razy większej liczby anionów chlorkowych, które równoważą ładunek kationów. Uwodniony chlorek glinu jest związkiem jonowym i zachowuje się typowo do innych związków tego typu.
Ad 6) Jaką temperaturę topnienia mają sole? Istnienie soli, które mają tak niską temperaturę topnienia, że są cieczami w temperaturze pokojowej, a nawet dymiącymi na powietrzu, także wyklucza się z jonowością wiązań pomiędzy tytanem a chlorem, czy cyną i chlorem.
Ad 7) Chlorek chromu(III) – chemiczny kameleon. Istnienia izomerii nie można wyjaśnić w oparciu o wyłącznie jonowy charakter wiązania chloru z chromem, czy tlenu z chromem.
Ad 8) Dlaczego chlorek glinu jest dimerem? Osiągania konfiguracji helowca będącego na prawo od danego pierwiastka – nie można wyjaśnić wiązaniem jonowym, które może wyjaśniać co najwyżej osiąganie konfiguracji elektronowej helowca będącego przed danym pierwiastkiem. Gdyby wiązanie pomiędzy glinem, a chlorem było jonowe, to w krysztale tego związku mielibyśmy kationy Al3+ wyraźnie rozdzielone od anionów Cl–. Ale co zrobić, gdyby wiązanie miało charakter kowalencyjny? Otrzymalibyśmy cząsteczkę AlCl3, w której centralny atom ma sekstet elektronowy. Zatem jak otrzymać konfigurację helowca? Trzeba wtedy utworzyć czwarte wiązanie kowalencyjne – o charakterze donorowo-akceptorowym. Czwarte wiązanie tworzy atom chloru, który ma 3 wolne pary elektronowe – w chlorku glinu powstają mostki Al-Cl-Al. Taka sytuacja nie może mieć miejsca w związku jonowym, gdzie nie jesteśmy w stanie wskazać, który atom wiąże się z którym. Nawet maturzyści muszą wiedzieć, że związki berylu nie są jonowe. No cóż, jak to zwykło się w szkole mówić: wyjątek… Pozwólmy jednak, że kwestię wyjątków teraz przemilczę i przejdę dalej. Beryl ma zaledwie dwa elektrony walencyjne i gdyby utworzył wiązanie jonowe, to musiałby się ich pozbyć. Ale nawet uczniowie muszą pamiętać, że beryl takowych nie tworzy. Uzyskuje oktet tworząc wiązania kowalencyjne, w tym aż dwa koordynacyjne.
Ad 9) Anomalia temperatur zmiany stanu skupienia. Wynika to z różnej budowy tych soli – w chlorkach obecne są mostki chlorkowe, których jest więcej na w chlorku na niższym stopniu utlenienia. Podnosi to temperaturę topnienia, bo ich sieć jest trwalsza – spajana większą ilością wiązań koordynacyjnych.
Zakończenie
Z tego dość obszernego artykułu dowiedzieliśmy się, że sole to nie tylko związki jonowe, ale także cząsteczkowe, co więcej, sole mogą tworzyć polimery, a nawet trójwymiarowe sieci. Jeśli się przyjrzeć, to zauważymy, że jonowego charakteru nadaje wielu solom często dopiero woda (lub inny rozpuszczalnik), która tworzy wiązania koordynacyjne z atomem metalu, tworząc tzw. akwakompleks, a jonowo wiążą się dopiero te atomy, dla których zabrakło już miejsca w sferze walencyjnej metalu (jak w przypadku FeCl3*6H2O). Można się spotkać ze stwierdzeniem, że tylko sole berylu nie są jonowe, czasem ktoś wspomina jeszcze o solach rtęci – ale nie jest to prawdą. Jonowy charakter częściej pojawia się w przypadku soli kwasów tlenowych, niż beztlenowych, przy czym w przypadku hydratów – zazwyczaj mamy do czynienia z akwakompleksem. Zauważmy jak wiele soli, których nie rozpatrujemy z przyzwyczajenia jako związków kompleksowych – to w istocie nimi jest. Wiele z nich tworzy kompleksowe kationy, np. wspomniane akwakompleksy. Są też kompleksy obojętne. Skala Paulinga zaś – nie jest specjalnie trafnym wyznacznikiem charakteru wiązania. Jednym z częściej pojawiających się przypadków jest AlH3 i pytanie o charakter wiązania. Często wtedy pada odpowiedź, że jonowe, bo to związek metalu z niemetalem, ale to także nieprawda, gdyż to kowalencyjny związek. Tegoroczna matura także poruszyła ten temat – pytanie o charakter wiązania węgla z litem – tutaj także wiele osób straciło punkty, odpowiadając, że wiązanie jest jonowe (bo wiąże się metal z niemetalem). Zastanówmy się też, czy gdyby bezwodne sole miały budowę jonową, to czy taki bezw. AlCl3 lub FeCl3 miałyby aktywność katalityczną w alkilowaniu czy chlorowaniu węglowodorów aromatycznych? Nie, i jak sądzę, wiele osób po przestudiowaniu mechanizmu tych reakcji odpowie także na pytanie: a dlaczego nie?
PS czasem przez swoją lekką złośliwość powtarzam, że AlCl3 jest związkiem jonowym, póki w zadaniu nie każą nam przypisać hybrydyzacji atomowi centralnemu lub określić, dlaczego cząsteczka AlCl3 jest strukturą płaską – czego nie dało by się określić, gdyby trzymać się ciągle założenia, że wszystkie wiązania AlCl3 są jonowe, a gdyby AlCl3 był w pełni jonowym związkiem, to kationy i aniony wcale nie musiały by leżeć w jednej płaszczyźnie.