Dlaczego strącają się osady, a HI jest mocnym kwasem?
Po raz kolejny do napisania krótkiego artykułu skłoniło mnie pytanie zadane na grupie dyskusyjnej. Dziś zatem krótko i zwięźle.
Pytanie brzmiało: „mam takie absorbujące pytanie, otóż zastanawiałam się nad mechanizmem powstawania osadów podczas reakcji strącania. Skąd np. jony Ba2+ wiedza, ze muszą się połączyć z jonami SO42- i utworzyć osad?”
To jest bardzo dobrze postawione pytanie i dobrze świadczące o podejściu autorki tegoż pytania. Skoro już zadała pytanie o strącanie BaSO4, to skupmy się na berylowcach i popatrzmy na rozpuszczalność molową (czyli w molach na litr wody) siarczanów w tej grupie, oraz dla porównania rozpuszczalność chlorków w grupie pierwszej:
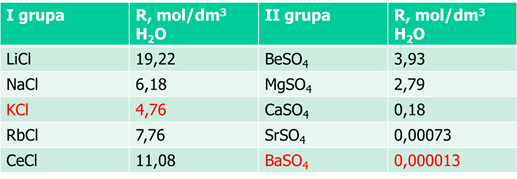
Jak widać, rozpuszczalność szybko spada w grupie. Podobną zależność zaobserwujemy dla węglanów w grupie drugiej. Zwróćmy też uwagę, że rozpuszczalność chlorków w grupie pierwszej takze przechodzi minimum – KCl.
Gdybyśmy wybrali jakiś dowolny pierwiastek i porównali rozpuszczalność związków tego pierwiastka, to się okaże, że np. CaCl2 jest dobrze rozpuszczalny, podczas gdy CaF2 – już nie, co też wydaje się dziwne. Siarczek baru BaS dobrze rozpuszcza się w wodzie, podczas gdy siarczek wapnia CaS – już nie… Zerknijmy na tabele poniżej i oceńmy, jak zmienia się rozpuszczlaność soli:

A teraz dla porównania halogenki wapnia i srebra:

Co więcej dobrze rozpuszczalny jest AgF, podczas gdy inne halogeny tworzą coraz mniej rozpuszczalne związki ze srebrem – najmniej rozpuszczalny jest jodek srebra AgI, a rozpuszczalność maleje w szeregu: AgF, AgCl, AgBr, AgI.
Jaki jest tego powód? Jak Wam się wydaje, czy łatwiej jest zbudować sieć krystaliczną, gdy kationy i aniony są podobnych rozmiarów, czy znacznie różniące się rozmiarami? Wyobraźmy sobie, że budujemy 2 modele kryształów, jeden z mandarynek i grejpfrutów, drugi z pomarańczy i grejpfrutów, który z nich będzie zbudować łatwiej? który z nich będzie też trwalszy? Tak samo jest z kryształami – łatwiej zbudować kryształ ze zbliżonych do siebie cząstek. Podobnie jak i ściany domu buduje się z tej samej wielkości elementów – gdyby mieszać pustaki z cegłami, to trudniej by się budowało a ściana nie byłaby tak wytrzymała. Cząsteczki rozpuszczalnika łatwiej będą rozbijać tę sieć krystaliczną, której elementy są do siebie bardziej dopasowane, czy mniej dopasowane? Jeśli w roztworze spotka się nagle kilka jonów mogących utworzyć dobrze dopasowaną sieć krystaliczną, to zaczną tworzyć zarodki krystalizacji i w rezultacie – strącenie osadu. Im mocniejszą sieć tworzą tym niższe stężenie w roztworze, przy którym mogą ją zacząć tworzyć, bo cząsteczki rozpuszczalnika nie mają wystarczającej siły, by ją rozbić powstający zarodek kryształu. Roztwór, w którym szybkość wybijania jonów z powierzchni kryształów jest równa szybkości wbudowywania się jonów z powrotem do sieci krystalicznej zwiemy roztworem nasyconym. Roztwór nasycony to nic innego jak roztwór, w którym szybkość rozpuszczania jest równa szybkości krystalizacji – jest to układ w stanie równowagi. Sieć krystaliczna zbudowana jest z jonów o przeciwnych znakach, więc sieć trzyma się kupy dzięki oddziaływaniom ładunków. Jednakże jeszcze dopasowanie elementów sieci do siebie sprawia, że sieć jest trwalsza. Rozpuszczalnik, czyli woda w tym przypadku wybija jony z powierzchni kryształów, jednak ze wzrostem stężenia jonów w roztworze coraz większe jest prawdopodobieństwo, że jon, który przeszedł do wody, uderzy w powierzchnię kryształu i się wbuduje z powrotem, bowiem wszystkimi procesami rządzi rachunek prawdopodobieństwa. Im trwalsza jest sieć, tym mniejsze stężenie jest potrzebne by szybkość krystalizacji wyrównała lub przekroczyła szybkość rozpuszczania. Powinniśmy zdawać sobie sprawę, że szybkość procesów zależy od stężenia – powyżej pewnego stężenia szybkość wbudowywania się w sieć krystaliczną jest większa niż jej szybkość rozpuszczania – bo większe jest wtedy prawdopodobieństwo wbudowania się jonu w sieć, niż jego wyrwania przez rozpuszczalnik, strąca się wtedy osad i narastają kryształy. Zmienić to może dopiero podniesienie temperatury, gdyż cząsteczki rozpuszczalnika poruszają się szybciej, więc mają wyższą energię i dzięki temu mają siłę wybić więcej cząsteczek z powierzchni kryształu – rozpuszczalność większości soli rośnie przecież ze wzrostem temperatury.
Jest taka teoria, pomijana na ogół w szkole, a wielka szkoda, tzw. teoria twardości kwasów i zasad Pearsona. Pearson powiązał rozmiary atomów/jonów z ich elektroujemnością oraz ich stopniem utlenienia i uszeregował je wg tzw. twardości – okazało się, że największe powinowactwo do siebie mają twarde kwasy* do twardych zasad* i miękkie zasady do miękkich kwasów, przy czym kwasem jest kation, a zasadą anion, teoria to dodatkowo uzupełnia teorię kwasów i zasad Lewisa. Teoria ta pozwoliła wyjaśnić m.i. niską rozpuszczalność wielu jonowych związków w wodzie oraz fakt, że wiele metali tworzy minerały siarczkowe. Mówi ona, między innymi, że najtrwalsze połączenia tworzą te atomy lub jony, które są rozmiarami do siebie bardziej dopasowane i nie ma tutaj znaczenia, czy są to połączenia kowalencyjne, czy jonowe. Odpowiedź na postawione przez autorkę pytanie: Ba2+ i SO42- tworzą ze sobą dobrze zorganizowaną sieć krystaliczną ze względu na zbliżone rozmiary – woda nie ma siły by wybić dużą ilość jonów z tej sieci. Wiele kationów metali ma rozmiary zbliżone do anionu siarczkowego – teraz sobie zobaczcie w tabelę rozpuszczalności na siarczki. A przy okazji zastanówcie się, dlaczego HI jest najmocniejszym kwasem beztlenowym, mimo tego, że w szeregu HF, HCl, HBr, HI to wiązanie H-F jest najbardziej polarne, a paradoksalnie H-F jest najsłabszym kwasem w tym szeregu. Wszystkie halogenowodory występują w równowadze z wodorem i gazowym halogenem, ale wśród gazowych halogenków wodoru to HI jest najmniej trwały – najłatwiej się rozpada na J2 i H2 i równowagowa zawartość wodoru i jodu w tym gazie jest największa:

Wiązanie H-X w gazie może rozpaść się symetrycznie (homolitycznie) na dwa rodniki: H* i I*. Jony w fazie gazowej to bardzo niekorzystny energetycznie stan, gdyż jony wymagają czynnika stabilizującego. Po wprowadzeniu halogenowodoru do wody, która ma bardzo dużą zdolność solwatowania jonów (czyli ich stabilizacji), wiązanie H-X może rozpadać się niesymetrycznie (heterolitycznie) na jony. Bardziej elektroujemny jest halogen, zatem to on ściąga do siebie elektrony:

Zarówno jony H3O+ jak i X– są solwatowane (stabilizowane) przez cząsteczki wody. I tak jak gazowy HI jest najmniej trwałą cząsteczką w stanie gazowym, tak i w roztworze wodnym ma ułatwione zadanie – jego dysocjacja elektrolityczna w wodzie zachodzi najłatwiej – kwas ten jest najmocniejszy z całej czwórki. Nadal nie wiecie dlaczego? To porównajcie sobie rozmiary wodoru z atomami halogenów, które są najmniej dopasowane do siebie?
Zwróćmy jeszcze uwagę na tzw. wodorki w grupie 15: NH3, PH3, AsH3, SbH3, BiH3 – najsłabszym kwasem jest tutaj NH3 – ma najlepiej dopasowane rozmiary tomów do siebie. Z kolei następne zwiazki nie dość, że są coraz mocniejszymi kwasami w wodzie, to jeszcze są coraz mniej trwałe. Znana jest próba lustra arsenowego czy antymonowego, polegajaca na osadzaniu się w formie lustra tych metali na szkle w wyniku ogrzania szklanej rury z tymi gazami. Z kolei BiH3 – w większości rozpada się nawet w temperaturze pokojowej.
Wróćmy na moment do srebra – jak wspomniałem, srebro wykazuje niezwykłą skłonność do reakcji z siarką. Dlatego czasem może nas zaskoczyć taka sytuacja:
Ag+ jest miękkim kwasem wg tej teorii, a anion siarczkowy i wolna siarka – miękkimi zasadami. Metaliczne srebro wykazuje niezwykłą zdolność do reakcji z siarką elementarną, a Ag2S jest jednym z najtrudniej rozpuszczalnych osadów! Miękkim kwasem jest też Au+ – złoto nie reaguje z mocnymi kwasami takimi i utleniającymi kwasami, jak H2SO4 czy HNO3, roztwarza się w wodzie królewskiej (zwanej z tego powodu właśnie królewską) a reaguje z np. z tiolami, czyli siarkowymi analogami alkoholi RSH – bardzo słabymi kwasami! Złoto zanurzone w tiolu pokrywa się warstewką z chemicznie związanego tiolu Au-SR.
CZY TEN ARTYKUŁ OKAZAŁ SIĘ POMOCNY? MASZ DODATKOWE SUGESTIE ALBO PYTANIA? NAPISZ DO NAS! A MOŻE CHCESZ TEŻ O CZYMŚ NAPISAĆ I OPUBLIKOWAĆ? DOŁĄCZ DO NAS! REDAKCJA@BIOMIST.PL
