Wpływ temperatury na szybkość reakcji egzotermicznej – sprostowanie częstego szkolnego błędu
Co jakiś czas spotykam się z pytaniami w sprawie wpływu czynników na reakcję równowagową. O regule przekory pisałem już sporo, jednakże chcę jeszcze nawiązać do niej. Co jakiś czas słyszę, że ze wzrostem temperatury szybkość reakcji egzotermicznej maleje. Z drugiej strony wiemy, że wzrost temperatury powoduje wzrost szybkości reakcji 2-4 razy. Czasem więcej niż 4 razy, czasem mniej niż 2 razy, po prostu reakcje są różne. To jak wyjaśnić fakt, że wzrost temperatury powoduje spadek szybkości reakcji egzotermicznej? Nie powoduje. Właśnie twierdzenie, że szybkość reakcji spadnie, jest błędem, który jest często powtarzany i przez nauczycieli, i przez podręczniki szkolne jak i zbiory zadań. Z reguły przekory wiemy, że usuwanie produktów reakcji z jej środowiska skutkuje, że reakcja dążąc do stanu równowagi zaczyna biec w stronę produktów. Jako produkt reakcji możemy potraktować też wydzielające się ciepło, zatem odbieranie ciepła też sprzyja reakcji. Tekst poniżej, choć zawiera trochę matematyki, jest sformułowany na poziomie odpowiednim dla uczniów liceum czy technikum.
Rozpatrzmy konkretny przykład. Hydratacja etylenu:
C2H4 + H2O ↔ C2H5OH, ΔH= -58,6 kJ/mol
W formie skróconej zapiszmy etanol jako EtOH. Jest to reakcja odwracalna, zatem możemy zapisać stałą równowagi tej reakcji:
K=[EtOH]/[C2H4][H2O ]
dla reakcji biegnącej w prawo w danej temperaturze (T):
C2H4 + H2O → C2H5OH
możemy zapisać szybkość reakcji:
V1=k1[C2H4][H2O ]
a dla reakcji rozkładu EtOH, czyli „w lewo”:
EtOH → C2H4 + H2O
A żeby dla wszystkich „w lewo” było bardziej widoczne :), to jeszcze może tak:
C2H4 + H2O ← EtOH
zapiszemy wyrażenie na szybkość:
V-1=k-1[EtOH]
I ok. A czymże jest równowaga? Czy wpuszczając dwutlenek siarki i tlen nad katalizator reakcja sobie biegnie i nagle przestaje biec po dojściu do równowagi? Nie. Nie ma takich równowag w przyrodzie. W przyrodzie występują tylko równowagi dynamiczne, a to tak jak z równowagą sił: na ciało działają siły, równe co do wartości, ale o zwrotach przeciwnych. Tak i w tym przypadku: zachodzą reakcje w obie strony, z szybkością równą co do wartości, ale przeciwnie skierowanymi. Tak więc w stanie równowagi reakcje biegną reakcje w obie strony, ale ich prędkości się wyrównują. Wypadkowa wynosi zero. Co nie znaczy, że nie biegnie żadna reakcja, jak na ciało w równowadze nie mogą nie działać żadne siły. A skoro w stanie równowagi prędkości się zrównują, to:
k1[C2H4][H2O ]=k-1[EtOH]
A po prostym przekształceniu otrzymamy:
k1/k-1=[EtOH]/[ C2H4][H2O ]
Czyli stosunek k1/k-1to nic innego jak stała równowagi tej reakcji.
Przyjmijmy teraz, że w temperaturze T stała równowagi tej reakcji wynosi 5. Czyli:
K=[EtOH]/[ C2H4][H2O ]=5
Zatem stała szybkości reakcji w prawo (hydratacji) jest w tej temperaturze 5 razy większa od stałej szybkości reakcji w lewo (dehydratacji etanolu). Czyli przyjmujemy, że k1=5, a k-1=1.
A gdzie ustali się stan równowagi? Jego znalezienie umożliwi nam tabelka:
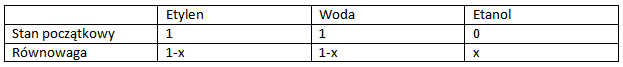
po wstawieniu wartości równowagowych do K otrzymujemy:
K=x/(1-x)²=5
rozwiązanie daje x=0,6417
Czy rzeczywiście przy takim stężeniu etanolu szybkości reakcji w obie strony się zrównują? Sprawdźmy.
[C2H4 ]=1-0,6417=0,3583
[H2O ]=1-0,6417=0,3583
V1=k1[C2H4 ][H2O ]=5*0,3583*0,3583=0,6417
A w lewo?
V-1=k-1[EtOH]=1*0,6417
Czyli prędkości wyszły równe.
Jednakże trzeba ważną rzecz sobie uświadomić. Wypadkowa prędkość reakcji odwracalnej, to różnica prędkości pomiędzy reakcją w prawo, a reakcją w lewo:
V=V1 – V-1
Spójrzmy na tabelę:

Wypadkowa prędkość jak widać, zmienia znak, a to oznacza, że gdzieś pomiędzy 0,3 a 0,4 stężenia początkowego etylenu lub wody prędkości się zrównują, co jest zgodne z tym co obliczyliśmy wcześniej (0,3583). Zobaczmy to jeszcze na wykresie:

A teraz w końcu pora podnieść temperaturę. Podniesiemy ją o zaledwie 10 stopni. Zmiana temperatury pociąga za sobą zmianę stałej szybkości reakcji, czyli k. Jednakże, jeśli zmiana temperatury ma wpływ na k1, to ma też wpływ na k-1. Ale! Ale ich współczynniki temperaturowe nie muszą być takie same. A to oznacza, że reakcja w jedną stronę jest bardziej czuła na zmianę temperatury niż w stronę przeciwną. Załóżmy, że nowa stała reakcji w prawo rośnie 2 razy przy wzroście temperatury o 10 stopni. A reakcji w lewo 4 razy przy tym samym wzroście. Co z tego otrzymamy?
k1=5*2=10, a k-1=1*4=4
Czyli nowa stała równowagi wynosi K=2,5
A to oznacza, że stan równowagi przesunął się bardziej w lewo. Podobnie jak poprzednio policzymy sobie skład stanu równowagowego i otrzymamy x=0,5367,
[C2H4 ]=[H2O ]=0,4633
[EtOH]=0,5367
A zatem osiągnęliśmy stan równowagi przy mniejszym stopniu przereagowania (lub bardziej po szkolnemu: przy niższej wydajności). A jak to ma się na wypadkową prędkość? Spójrzmy na tabelę:

Czyli prędkość wzrosła! Ale stan równowagi się zmienił na mniej korzystny.
Zobaczmy jeszcze zestawienie wypadkowych prędkości na wykresie:
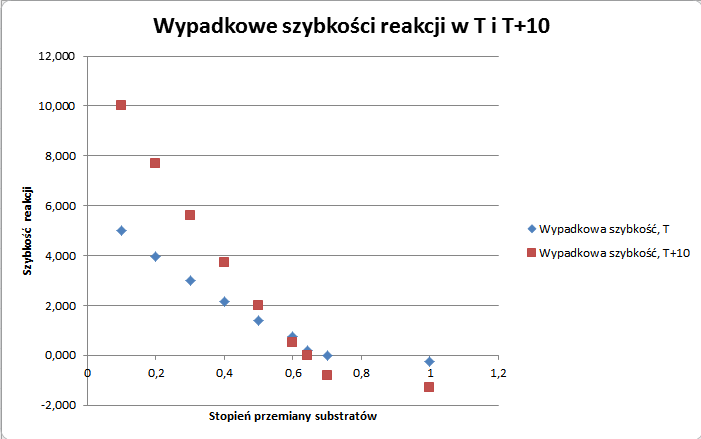
Innymi słowy: w przypadku odwracalnej reakcji egzotermicznej podniesienie temperatury wiąże się z szybszym dojściem do mniej korzystnego stanu równowagi. A w szkole często się mówi, że wydajność spadnie. Nie należy jednak mylić szybkości reakcji z osiąganym stanem równowagi! Stała równowagi nie mówi nam o rzeczywistej szybkości reakcji, tylko o stosunku stałych szybkości w prawo i w lewo do siebie.
A jak jest w przypadku odwracalnych reakcji endotermicznych? Te z kolei mają bardziej wrażliwą stałą k1 na wzrost T, niż k-1 i dlatego po analizie matematycznej widać, że ich stan równowagi zmienia się na bardziej korzystny i prędkość też wzrasta. Bo musi.
Wszystko się zgadza ale nie stosujmy zamiennie słów szybkość i prędkość. Szybkość jest skalarem a prędkość wektorem. Dlatego mówimy o szybkości reakcji , szybkości ścinania a nie o prędkości!
Dzień dobry!
Mam w zasadzie jedną uwagę. Prędkość dotyczy auta, roweru. W przypadku reakcji chemicznych mówimy o szybkości.
Poza tym ciekawe wytłumaczenie.
Pozdrawiam,
Anna
Prędkość jest wektorem, szybkość wielkością skalarną. Dzięki za uwagę, poprawię to 😉