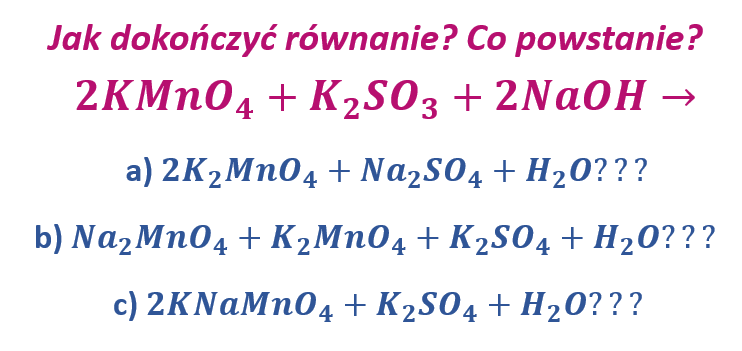Równania reakcji – postać jonowa a postać cząsteczkowa
Z postacią cząsteczkową i jonową równań reakcji spotykamy się często, ale są sprawy, które dla wielu stanowią zagwozdkę. W wielu przypadkach zapisanie jonowego równania reakcji nie stanowi problemu, ale cząsteczkowego dla tej samej reakcji – już tak. I to czasem spotykam na grupach dyskusyjnych. I o to to właśnie dostałem pytanie bezpośrednio. Z dziedziny tych, które lubię. Rozpatrzmy najpierw wyjściowe, a raczej: wejściowe równanie reakcji.

Ale co się stanie, gdy zamiast KOH, użyjemy NaOH?

Może powstanie K2MnO4 i Na2SO4?

Ale czemu akurat one? Więc może powstanie Na2MnO4 i K2SO4?

Tu jak widzimy, ze względu na brak odpowiedniej liczby kationów sodu musi powstać też K2MnO4. No ale czemu tak? A może kationy Na+ i K+ tworzą z anionami MnO42- sól podwójną?

A może jeszcze inna sól podwójna się tworzy? No właśnie. Która wersja jej poprawna? No bo skąd mamy wiedzieć „jak to się połączy ze sobą?” No właśnie, skąd? Póki były tylko kationy potasu, to nie mieliśmy problemu… A co, gdy dodać NaOH zamiast KOH? Które jony połączą się z którymi, byśmy mogli zapisać postać cząsteczkową? Jak to przewidzieć? Zadajmy sobie najpierw inne pytanie: czy którekolwiek równanie reakcji, w którym użyliśmy NaOH zamiast KOH ma sens? Stechiometrycznie się zgadza, ale reszta? Przecież na papierze to każda reakcja zachodzi, bo zbilansujemy wszystko. Właśnie to pytanie, które jest mi znane z różnych grup dyskusyjnych, ale pierwszy raz dostałem bezpośrednio pokazuje sedno problemu. Nie we wszystkich reakcjach jest uzasadnione, by zapisywać je w postaci cząsteczkowej. Wyjaśnimy, dlaczego. Przyjrzyjmy się pierwszej wersji z NaOH:

Jak w praktyce wygląda wykonanie takiej reakcji? Mieszamy ze sobą roztwory wodne: roztwór KMnO4 z roztworem NaOH i z roztworem K2SO3. Otrzymujemy ciemnofioletowy roztwór, który po dodaniu reduktora zmienia kolor na zielony. No właśnie – rozwór substratów przechodzi w roztwór produktów. Wszystkie nasze substancje (poza wodą) są związkami jonowymi. W roztworze są zdysocjowane praktycznie całkowicie. Teraz naszą postać cząsteczkową zamienimy na formę jonową:

Uporządkujmy to teraz nieco inaczej, dla większej przejrzystości:

A teraz rozpatrzmy teraz wersję z solą podwójną:

Po identycznym zabiegu otrzymujemy:

Czyli to samo. I trzecia wersja da nam ten sam wynik. A wynika to stąd, że otrzymujemy zupę jonową. Żadne kationy nie tworzą tutaj trwałego połączenia z jakimiś konkretnymi anionami. Nie konkretnych „cząsteczek”*. Z perspektywy kationów jest obojętne, co robią aniony ze sobą. Co więc z tą postacią cząsteczkową? Każda jest prawidłowa i żadna nie jest prawidłowa. Bo to i tak nie ma znaczenia, skoro nic z niczym się nie wiąże. Zobaczmy: w wypadku reakcji wymiany podwójnej nie mamy problemu z ustaleniem co się z czym połączy – pomaga nam w tym tabela rozpuszczalności, z której odczytujemy, że np. jony Ag+ i Cl– wiążą się ze sobą w osad AgCl.

Pomijając reakcje wymiany podwójnej to w ogromnej liczbie przypadków zapisywanie w postaci cząsteczkowej równań reakcji, w których otrzymujemy roztwór i zupę jonową – nie ma sensu. Czyli w rozważanym przypadku nie ma to sensu. Ma to sens dopiero, gdy dana reakcja służy do otrzymywania jakiegoś związku, czyli jest podstawą metody preparatywnej.I tak w przypadku reakcji, gdzie zamiast K2SO3 użyć BaSO3 jako reduktora możemy ustalić postać cząsteczkową, np. dla takiej reakcji, której równanie widzimy poniżej.

Nie powstanie nam tutaj inny związek baru niż BaSO4, bo związek ten jest praktycznie nierozpuszczalny, w przeciwieństwie do pozostałych soli. Innej kombinacji niż KNO3 i Mn(NO3)2 zresztą nie mamy. No chyba żeby powstała sól podwójna, co w niektórych przypadkach jest możliwe. Podobnie cząsteczkową postać można zapisać w przypadku redukcji K2Cr2O7 alkoholem w środowisku kwasowym. Dopóki pozostajemy w roztworze, to wygląda to tak (w szkolnym zapisie):

Ale w pełnej postaci jonowej otrzymamy:

To też postać „uszkolniona” bo ja bym zapisał 4H+ + 4HSO4– po lewej. Ale co, gdybyśmy ten roztwór odparowali? Aldehyd i woda odparują, ale jony K+, Cr3+, SO42- i część wody utworzą jeden związek: dwunastowodny siarczan(VI) chromu(III)-potasu KCr(SO4)2*12H2O. Zauważmy, że w reakcji powstaje za mało wody, by ten związek powstał, ale jest tam ona użyta jako rozpuszczalnik. Redukcja alkoholem zakwaszonego przez H2SO4 roztworu K2Cr2O7 jest metodą otrzymywania tego ałunu. Całość możemy zamknąć w bilansie (równaniu) stechiometrycznym:

Takie zapisy znajdziemy np. w preparatykach. Bo dotyczy to sytuacji, gdy można otrzymać konkretne substancje. A w roztworze to i tak nie ma sensu i nikt nie powinien nikogo zmuszać do zapisywania postaci cząsteczkowej. A ogólnie to ma sens tylko dlatego, że w tym wypadku takie substancje jesteśmy w stanie otrzymać z mieszaniny poreakcyjnej i ma one znaczenie preparatywne. Przedstawione równanie dotyczy bilansu, gdy odparujemy roztwór poreakcyjny. W większości znanych mi źródeł i tak jest on niezbyt poprawny, bo widzę w zapisie cząsteczkowym K2SO4 + Cr2(SO4)3. A wracając do wejściowego równania: to nic się nie strąca, byśmy mogli powiązać jakoś jony, które z którymi się zwiążą. I jak sami zauważymy, takich przypadków jest sporo. Póki więc rozpatrujemy roztwory, z zwykle zapisujemy reakcje zachodzące po zmieszaniu wodnych roztworów, to zapis cząsteczkowy nie ma sensu. Co innego, gdyby zamiast wody rozpuścić substraty w innym rozpuszczalniku. Np. w takim, w którym dobrze rozpuszczają się KMnO4, K2SO3 i NaOH, ale źle rozpuszcza się np. K2MnO4. Wtedy jesteśmy w stanie wydedukować resztę, bo byłaby tylko jedna kombinacja:

Albo gdyby znaleźć rozpuszczalnik, w którym potencjalna sól podwójna była słabo rozpuszczalna:

To hipotetyczne sytuacje, bo być może ani taka sól podwójna, ani odpowiedni rozpuszczalni nie są znane. Ale już w przypadku:

Otrzymujemy sól podwójną, bo jest ona mniej rozpuszczalna niż K2SO4 czy Cr2(SO4)3*7H2O. W przeciwnym przypadku moglibyśmy otrzymać równomolową mieszaninę K2SO4 i Cr2(SO4)3*7H2O.
Konkretny przebieg reakcji można wymusić też dodając odpowiedniego rozpuszczalnika do roztworu poreakcyjnego, a nawet „przedreakcyjnego” – jeśli zmieszamy wodne roztwory CuSO4 i np. KCl, to otrzymujemy też roztwór. Pozornie nic się nie dzieje**. Ale jeśli dodać tam alkoholu, to wytrąci się K2SO4 i otrzymamy roztwór CuCl2 – wszystko dlatego, że CuCl2 dobrze rozpuszcza się w alkoholach, a K2SO4 jest w nich bardzo słabo rozpuszczalny.

Możemy przyjąć, że reakcja zaszła dopiero po dodaniu alkoholu**. To nas może trochę dziwić, bo uczymy się, że i CuCl2 i K2SO4 są dobrze rozpuszczalne i jak popatrzymy do tabeli rozpuszczalności, to żaden z nich się nie strąca. Ale tabela rozpuszczalności dotyczy wodnych roztworów. A wymiana rozpuszczalnika na inny to też inna chemia niż ta, do której przywykliśmy i której się uczymy i w kategoriach której myślimy.
Wspomniałem o tym, że takie zapisy, jak z tym ałunem, spotykamy w preparatykach. I tak preparatyka Brauera podaje takie równanie redukcji KMnO4 w silnie zasadowym środowisku (stężona zasada sodowa – wtedy powstają manganiany V, a nie manganiany (VI):
![]()
Zapis taki wynika z faktów, że 1) do reakcji używamy nie roztworu K2SO3, tylko stałego (krystalicznego) K2SO3*7H2O, a 2) w roztworze poreakcyjnym pojawiają się kryształy (osad) najsłabiej rozpuszczalnego Na3MnO4*10H2O. Kryształy te można odsączyć, a przesącz jest roztworem Na2SO4 i KOH, czy roztworem K2SO4 i NaOH? Nie rozstrzygniemy tego, bo wracamy do punktu wyjścia, a raczej wejścia. Dlatego ostatnie dwa wyrazy prawej strony równania należy traktować czysto formalnie, a do tego można zamiennie napisać tak:

I w sumie to nawet wygląda lepiej niż oryginalne równanie, bo w pierwotnej wersji mieliśmy niewykorzystane jony OH– w reakcji. Gdyby fioletowy roztwór przeszedł po prostu z niebieski roztwór – to zapis w formie cząsteczkowej znowu nie miałby większego sensu…No bo znowu: a może powstanie K3MnO4? W końcu jony potasu też tam mamy 😉 A że coś konkretnego się wytrąca – to ma to sens.
Kończąc: nie bez powodu pisze się redoksy (np. na maturze) w postaci jonowej. Bo często tylko jonowy zapis ma sens. Zmuszanie więc kogoś, by zapisał postać cząsteczkową reakcji KMnO4 + K2SO4 + NaOH zachodzącej w roztworze wodnym („Popatrzcie dzieci, kolor z pomarańczowego zmienił się na zielony”) nie ma sensu pod względem chemicznym. Chyba, że jesteśmy w stanie których produkt wydzielić i układamy bilans dla metody preparatywnej, ale w probówce – sensu to nie ma.
* W roztworze poreakcyjnym mogą istnieć małe ilości par jonowych. Pojęcie to wyjaśniam tutaj.
**W rzeczywistości ze względu na kowalencyjnych charakter CuCl2 reakcja zachodzi także w roztworze wodnym, ale jej produkty są dobrze rozpuszczalne. W roztworach o niezbyt małym stężeniu CuCl2 jest słabo zdysocjowany – po zmieszaniu roztworu CuSO4 z roztworem KCl, NaCl itp. obserwujemy zmianę zabarwienia z niebieskiej do zielonej – typowej dla roztworu CuCl2. Dodanie alkoholu umożliwia wytrącenie jonowego produktu reakcji.