Siarczan miedzi bez użycia kwasu siarkowego
Niebieskie kryształki siarczanu miedzi są znane każdemu chemikowi od najwcześniejszych przygód z chemią i doświadczeniami chemicznymi. Związek ten, a konkretnie jego uwodniona postać, pojawia się w każdym podręczniku chemii. Nastoletni eksperymentator-amator wielokrotnie jako przedmiot swoich pierwszych eksperymentów z kryształami, roztworami czy chemią analityczną. Któż z nas nie bawił się kiedyś w hodowlę kryształów CuSO4*5H2O, nie strącał wodorotlenku miedzi, nie wykrywał jonów miedzi w reakcji z amoniakiem nie używając do tego wszystkiego poczciwego siarczanu miedzi? A może ktoś go sam otrzymywał? Przepisy są dość łatwe, wystarczy przerobić miedź, tlenek miedzi (II) czy węglan miedzi (II) lub podobne im substancje. Zdobycie stężonego kwasu siarkowego może stanowić problem dla nastoletniego, początkującego chemika, a i stanowi dla niewprawionych osób zagrożenie dla własnego bezpieczeństwa. Kupno siarczanu miedzi nie stanowi problemu, gdyż to odczynnik dostępny i tani. Jeśli mamy warunki i odczynniki, to możemy się pokusić o otrzymywanie siarczanu miedzi. A co zrobić, jeśli nie ma możliwości użycia kwasu siarkowego? No to można kupić. Siarczan miedzi dostępny jest nie tylko w sklepach z odczynnikami, co nawet w ogrodniczych, gdyż sól ta służy do otrzymywania płynu do spryskiwania drzewek dla ochrony przed grzybami chorobotwórczymi. Ale jak go otrzymać nie mając do dyspozycji kwasu siarkowego? Hmm… No to może reakcja wymiany podwójnej? Bierzmy tabelę rozpuszczalności i pokombinujmy. Możnaby otrzymać siarczan miedzi w reakcji:
Możnaby otrzymać siarczan miedzi w reakcji:
![]()
ZnF2 jest osadem w tym przypadku. Ale CuF2 dla domowego chemika jest prawie nie do zdobycia. No to inny przykład:

Tutaj dochodzi ekonomia. W żadnym wypadku nie należy marnować drogiego związku do otrzymania taniego. No to może jeszcze jakiś inny sposób? No to pomyślmy… I cisza…
A więc by nie trzymać dłużej w napięciu i zaspokoić ciekawość a przy okazji podać oryginalną metodę otrzymywania tej soli, opiszę swoją przygodę sprze 15 lat (na chwilę publikacji tego tekstu, czyli w roku 2016). Pracowałem kiedyś jako chemik eksperymentator-amator, a swoje doświadczenia prowadziłem zwykle w słabo wyposażonej piwnicy, której cześć stanowiła moje laboratorium. Pewnego dnia nie mogłem się nadziwić, gdy na blacie zrobionym z drzwi starej szafy, na którym też pracowałem, znalazłem duże kryształy siarczanu miedzi! Skąd one się wzięły? Przecież nie pracowałem z tym związkiem ostatnio, nie mogłem rozlać jego roztworu itp. Jednakże przyglądając się tym kryształom zacząłem prowadzić „śledztwo”. Pomiędzy tymi kryształami były strzępki jakiejś gumy. Po przyjrzeniu się im stwierdziłem, że są to resztki izolacji kabla, który trzymałem właśnie w tej części blatu. Ale jak metaliczna miedź przeszła w sól? Przecież to taki odporny metal. Skojarzyłem jednak, że kilka tygodni wcześniej pracowałem na tym blacie z dużą ilością nasyconego roztworu siarczanu amonu (NH4)2SO4, którego część rozlałem, a jako że blat był nierówny to jego część ściekła w stronę tego drutu miedzianego. Zatem spotkały się jony siarczanowe oraz metaliczna miedź. Tylko jak tam miedź przereagowała w sól? Miedź (II) chętnie tworzy kompleksy z amoniakiem. Jeśli do r-ru soli miedzi (II) dodać stężonego amoniaku, to powstaje intensywne granatowe zabarwienie. Jeśli do wody amoniakalnej wrzucić kawałek nieoczyszczonego drutu miedzianego, to po chwili woda amoniakalna zacznie przybierać niebieską barwę, od tworzących się rozpuszczalnych związków kompleksowych miedzi. Praktycznie nierozpuszczalne w wodzie związki miedzi w reakcji z amoniakiem tworzą jon [Cu(NH3)4]2+, który jest dobrze rozpuszczalny w wodzie. Skoro miedź zostanie w ten sposób oczyszczona na powierzchni, to jest narażona na działanie tlenu atmosferycznego, który chętnie z nią reaguje, dając CuO. A ten ponownie roztworzy się w amoniaku dając wodorotlenek tetraaminomiedzi (II). Jak wiadomo, amoniak jest słabą zasadą. Sole amonowe w wodzie hydrolizują, uwalniając stopniowo amoniak. Amoniak ten jest w stanie utworzyć kompleks z miedzią. Zatem zachodzące procesy na moim blacie zapiszemy tak mniej więcej tak:
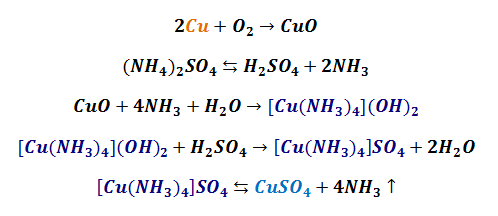
Kompleksowa sól, czyli siarczan tetraaminomiedzi (II) jest nietrwała i współistnieje w równowadze z amoniakiem i siarczanem miedzi (II). Ponieważ w powietrzu stężenie amoniaku jest śladowo małe, to sól ta chętnie oddaje amoniak, który się ulatnia w powietrze a pozostaje jako trwały produkt siarczan miedzi (II). Sumaryczne równanie miałoby postać:

Ponieważ reakcja zachodzi w środowisku wodnym, powstaje nam hydrat CuSO4*5H2O. Zatem mając odrobinę cierpliwości, spróbujmy podobnie przerobić miedź w użyteczną sól. Kawałek przewodu miedzianego, najlepiej w postaci zwoju cieniutkich drutów zalewamy stężonym r-rem siarczanu amonu tak, aby nie pokryć całej miedzi roztworem, tylko zapewnić dostęp tlenu do jej powierzchni. Przez kilka tygodni obserwujmy powstawanie siarczanu miedzi, aż do wyraźnego zakończenia reakcji. W razie potrzeby związek należy oczyszcić przez krystalizację. I tak oto przez własną niechlujność powstała oryginalną metoda otrzymywania siarczanu miedzi (II). Jestem ciekaw wyników innych amatorów. Siarczan amonu użyty w tym niezamierzonym doświadczeniu był zakupiony w sklepie ogrodniczym jako nawóz sztuczny. Doceńmy to, co daje nam, chemikom, natura w sklepach ogrodniczych, z farbami i lakierami, składach budowlanych, aptekach i drogeriach! A siarczan amonu jako nawóz jest bardzo tani, rzędu 3 PLN za 1 kg. No to co? No to do pracy 🙂
PS niestety, opisana historia miała miejsce, gdy cyfrowe aparaty fotograficzne były jeszcze nowością i luksusem i nie wykonywano wtedy takiej ilosci zdjęć jak w obecnych czasach, z djęcia te wymagały przecież wywołania u fotografa, stąd też fotografia ma charakter czysto poglądowy, a widoczny kryształ pochodzi z całkowicie zaplanowanej hodowli.

DMchemik propsy za metodę i podziękowania za wkład na pewnym forum internetowym, twoje posty nawet sprzed lat wciąż uczą maturzystów, jak dobrze to się okaże pojutrze (maturka)
No proszę, człowiek uczy się przez całe życie. Oryginalna metoda.