Sprawne posługiwanie się równaniem Clapeyrona
W obliczeniach związanych z gazami często posługujemy się prawami gazowymi, a przede wszystkim równaniem stanu gazu doskonałego, czyli równaniem Clapeyrona. Równanie to często błędnie zwane jest równaniem gazu doskonałego – tymczasem jest to równania STANU gazu doskonałego, a nie samego gazu.
Już w 1662 Robert Boyle, a cztery lata później Edme Marriotte eksperymentując z gazami stwierdzili niezależnie od siebie, że:
W stałej temperaturze objętość danej masy gazu jest odwrotnie proporcjonalna do jego ciśnienia
Co zapisujemy równaniem:
![]()
Lub często jako:

Z kolei na przełomie XVIII i XIX wieku zostały sformułowane dwa kolejne prawa:
Prawo Gay-Lussaca:
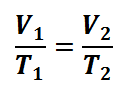
Oraz prawo Charlesa:

Wszystkie 3 prawa zostały zebrane w jedno ogólne prawo, zapisywane jako równanie stanu gazu doskonałego, które znamy z podręczników do chemii w postaciach:
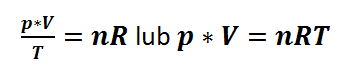
Ponieważ zarówno n jak i R są liczbami stałymi, to możemy też zapisać:

Przyjmijmy początkowe wartości dla stanu gazu:

Zmieniamy stan gazu, czyli jego parametry, ale jego liczba cząsteczek/atomów nie zmienia się w trakcie przemiany (n=const):

Czyli:

Otrzymaliśmy postać równania Clapeyrona, od której ja w liceum zacząłem swoją trwającą do dziś przygodę z gazami doskonałymi.
Teraz zauważmy, że jeśli zmieniamy warunki, to możemy zmienić temperaturę i objętość, ale nie zmienić ciśnienia – mówimy więc o przemianie izobarycznej:

Skracamy powtarzające się wyrazy:
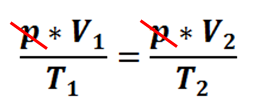
I otrzymujemy prawo Gay-Lussaca:
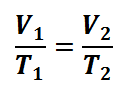
Teraz z kolei załóżmy, że prowadzimy przemianę izotermicznie:

Skracamy wyrazy powtarzające się:

I otrzymujemy prawo Boyle’a-Mariotta:
![]()
Możemy też prowadzić przemianę w stałej objętości:

Skracamy i otrzymujemy prawo Charlesa:
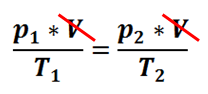

I tym sposobem zyskujemy dwie rzeczy:
- możemy wyprowadzić każde z trzech praw gazowych,
- możemy szybko obliczyć szukaną wielkość, bez konieczności żmudniejszego liczenia z wykorzystywaniem uniwersalnej stałej gazowej,
- nie musimy się bać, że pomylimy równanie opisujące któreś prawo i zastanawiać się, którego prawa użyć.
Wydaje się to dość oczywiste, a jednak większość osób nie ułatwia sobie życia.
Użyłam p1*v1/T1=p2*v2/T2 na maturze i dostałam 0 pkt, bo wzór jest podobno nieprawidłowy-według egzaminatora. Powinnam znać tylko p*v=nRT 😀 Śmiechu warte… Odwołanie poszło, ale na marne 😀
Jako student chemii i erudyta muszę w kontekście egzaminatorów i twórców podręczników powiedzieć jedno – w dużej mierze to niestety idioci z tytułem.
@Agggg
Trzeba było wyprowadzić ten wzór. Pozdrawiam,
egzaminator