Bilans jonowo-elektronowy
Zobacz na filmie, jak proste jest bilansowanie metodą jonowo-elektronową.
Szersze informacje dostaniesz podczas analizy artykułu poniżej, lub możesz skorzystać z mojej lekcji nagranej (Naciśnij tutaj po szczegóły).

Czy bilansowanie równań reakcji redoks może być proste? Może być proste bardzo! A nawet przyjemne. W praktyce można odnieść wrażenie, że opanowanie bilansowanie równań reakcji redoks to wręcz zwieńczenie dzieła edukacji. I choć temat jest tyle lat wałkowany, to jednak uważam, że napisać o nim zwięzły tekst trzeba koniecznie. Skąd wynikają problemy? Czy znamy metody bilansowania równań reakcji redoks, albo czy umiemy się nimi posługiwać prawidłowo? Czy znamy założeniach tych metod? A co jeśli problem bierze się z tego, że zostaliśmy wprowadzeni w błąd i nieodpowiednio posługujemy się danymi metodami? Tekst ten powinien przysłużyć się tym, którzy mają problem z bilansowaniem równań reakcji, zwłaszcza z udziałem związków organicznych, które cieszą się złą sławą. Artykuł ten polecam pod rozwagę także nauczycielom, gdyż pozwoli przyspieszyć pracę w sytuacji, gdy mają zagwozdkę podczas próby bilansowania jakiegoś kłopotliwego przypadku.
Wszystkich czytelników borykających się z bilansowaniem równań zachęcam do głębszej analizy teksu i rozpisania na kartce wszystkich poruszonych przypadków.
Naukę bilansowania równań reakcji chemicznych rozpoczynamy od metody bilansu materiałowego i jest to skuteczna metoda. Potem zostaje wprowadzone pojęcie stopnia utlenienia i co za tym idzie – reakcji redoks. Reakcjami redoks nazywamy takie reakcje, w których dochodzi do zmiany stopni utlenienia pierwiastków. Na początkowym etapie edukacji niewiele osób zdaje sobie sprawę z tego, że uczy się lub potrafi już bilansować równania reakcji redoks zanim to pojęcie zostaje wprowadzone, zobaczmy na kilka podręcznikowych reakcji redoks, które muszą umieć zbilansować najmłodsi adepci:

Z czasem napotykają także na bardziej skomplikowane przypadki, które także można uzgodnić metodą bilansu materiałowego. Zatem uczniowie potrafią, a przynajmniej powinni potrafić uzgodnić równania reakcji redoks, nie mając jeszcze świadomości, co ten termin oznacza. Ale w przypadku utleniania etanolu w zakwaszonym roztworze dichromianu(VI) potasu:

Po uzgodnieniu otrzymujemy równanie reakcji:
![]()
Ustalenie współczynników stechiometrycznych jest kłopotliwe wspomnianą metodą. Nie jest to niemożliwe, jest po prostu kłopotliwe. W takich przypadkach z pomocą przychodzi np. bilans elektronowy. Metoda ta polega na przypisaniu stopni utlenienia atomom w substratach i produktach, a następnie przypisanie liczby wymienianych elektronów atomom tych pierwiastków, które zmieniają stopień utlenienia podczas reakcji. Spróbujmy to zrobić – znajdujemy atomy, które formalnie zmieniają stopień utlenienia. Jest to pierwszy atom węgla w cząsteczce etanolu (wg kolejności numerowania atomów w łańcuchu): z –I na I, oraz atomy chromu z VI na III. Zapiszmy równania połówkowe:

Aby liczba wymienianych elektronów się zgadzała, to pierwsze równanie połówkowe musimy pomnożyć razy trzy, a drugie razy dwa:

Oznacza to, że bilans rozpoczniemy od przypisania współczynników stechiometrycznych przy wzorze alkoholu: 3, oraz dichromianu(VI) potasu: 1, bo w jego wzorze sumarycznym są obecne 2 atomy chromu:

A teraz używając dodatkowo znanego już wcześniej bilansu materiałowego dochodzimy do tych samych współczynników stechiometrycznych. Widzimy więc, że stopień utlenienia przyszedł nam z pomocą w przypadku, gdy użycie bilansu materiałowego jako jedynej metody bilansowania jest kłopotliwe.
Drugą metodą pomocniczą jest bilans jonowo-elektronowy. Metoda ta polega używaniu cząsteczek wody, jonów H+ lub jonów OH- do bilansowania równań. Na początek spróbujmy zbilansować razem prosty przypadek utleniania chlorku żelaza(II) chlorem:
![]()
Rozbijamy na jony mocne elektrolity i po redukcji wyrazów podobnych otrzymujemy równanie w postaci jonowej skróconej:

Widzimy, że kation żelaza pozbył się elektronu (utlenił):
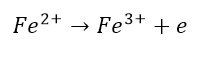
Z kolei chlor wzbogacił się w elektrony (zredukował):

Aby wyrównać liczbę elektronów w obu równaniach, to mnożymy odpowiednio te równania:
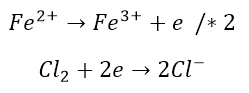
Teraz sumujemy równania połówkowe:

A w postaci cząsteczkowej otrzymamy:
![]()
Czyli zbilansowaliśmy proste równanie. Jednakże częściej wymaga się od nas bilansowania równań reakcji, w których dochodzi do przenoszenia atomów tlenu pomiędzy cząsteczkami/jonami, np., jak widać poniżej w utlenianiu jonu azotanowego(III) przez manganian(VII) potasu w kwasowym środowisku:

Reakcję tę przeprowadza się w roztworze wodnym. Ponieważ chcemy użyć bilansu jonowo-elektronowego, to rozbijamy na jony mocne i dobrze rozpuszczalne w wodzie elektrolity. Po skróceniu powtarzających się wyrazów otrzymujemy:

Przyjrzyjmy się jonowi azotanowemu(III) – w trakcie reakcji przechodzi w jon azotanowy(V), czyli wzbogaca się o atom tlenu. Przyjmijmy, że cząsteczka wody jest donorem anionu tlenkowego O2-, a pozostają z niej dwa kationy wodoru:

Żeby ładunki się zgadzały, anion po prawej stronie musiałby mieć ładunek 3-. A jednak powstaje jednoujemny – zabierzmy mu więc nadmiarowe elektrony:
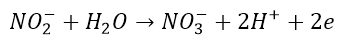
Otrzymaliśmy w ten sposób połówkowe równanie utleniania. Utleniania, bo aby wyrównać strony musieliśmy odebrać elektrony z produktu. A co z anionem manganianowym(VII)? Pozbywa się atomów tlenu i przechodzi w jon prosty Mn2+. Załóżmy teraz, kationy wodoru, których pełno w środowisku reakcji łączą się z tlenem i tworzą cząsteczki wody. Aby mogły się z nimi połączyć, od anionu MnO4– muszą się odłączyć 4 aniony O2-. Zapiszmy to:

Ponownie nie zgadzają się ładunki. Jon manganu po prawej stronie musiałby mieć ładunek 7+, aby się wyrównać z lewą stroną. Musimy wiec dostarczyć dodatkowo 5 elektronów, aby otrzymać równanie:
![]()
otrzymaliśmy połówkowe równanie redukcji – bo dostarczyliśmy elektronów. Zobaczmy na oba równania zestawione obok siebie:

Aby wyrównać elektrony, pierwsze równanie mnożymy razy pięć, a drugie razy dwa:
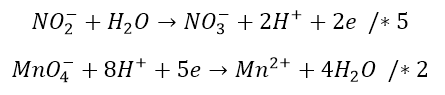
sumujemy wymnożone równania i otrzymujemy:

A po skróceniu:
![]()
lub w zapisie cząsteczkowym:

Widzimy, że do zbilansowania równania reakcji metodą jonowo-elektronową nie trzeba uzupełniająco posługiwać się bilansem materiałowym. Zauważmy też, że protony pełnią funckę przenośników atomów tlenu. Dla odmiany rozpatrzymy utlenianie azotanu(III) przez KMnO4 w środowisku zasadowym:
![]()
rozbijamy mocne elektrolity na jony, po skróceniu dostajemy:

Jon azotanowy(III) ponownie się wzbogacił w tlen, czyli utlenił. Co jest jego donorem? W środowisku reakcji mamy dostępne cząsteczki wody, oraz jony wodorotlenkowe. Gdybyśmy wybrali wodę, to otrzymamy kationy H+, które zobojętniły by się z jonami OH–. Zauważmy jednak, że gdyby dwa jony OH- przereagowały ze sobą, to mogą utworzyć cząsteczkę wody oraz anion tlenkowy:
![]()
Zatem donorem anionu tlenkowego są dwa aniony wodorotlenkowe. Utleniamy zatem anion azotanowy(III):

Aby wyrównać ładunki trzeba dodać po prawej stronie dwa elektrony (lub inaczej można powiedzieć, że wyciągamy je z anionu NO33-, który powstałby po przyłączeniu anionu tlenkowego do NO2–).
![]()
Otrzymaliśmy równanie połówkowe utleniania. Teraz patrzymy na to, co w reakcji dzieje się z jonem MnO4– – nie zmieniła się liczba atomów, za to wzrósł jego ładunek ujemny, czyli trzeba mu dostarczyć jedynie potrzebną liczbę elektronów.

I tak wygląda równanie połówkowe redukcji. Zbilansujmy elektrony w obu równaniach:
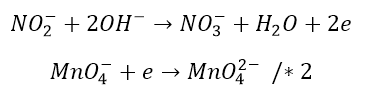
Dodajemy równania do siebie:

A cząsteczkowo otrzymaliśmy:
![]()
Utlenianie tego samego jonu można przeprowadzić w środowisku obojętnym:

Zauważmy, że choć rozpoczynamy od środowiska obojętnego (wodnego), to w trakcie tej reakcji ulega ono alkalizacji. Musimy więc wygenerować aniony wodorotlenkowe podczas bilansowania. Ponadto weźmy pod uwagę, że gdyby anion tlenkowy przereagował z cząsteczką wody, to otrzymamy 2 jony wodorotlenkowe:
![]()
Anion MnO4– musi się pozbyć dwóch atomów tlenu. Zapiszmy więc równanie połówkowe:

ładunki się nie zgadzają – musimy wprowadzić dodatkowe elektrony, bo w przeciwnym razie zamiast MnO2 musiałby powstać MnO23+:
![]()
Otrzymaliśmy równanie redukcji. Teraz jon azotanowy(III):

Mamy już zestaw dwóch równań połówkowych. Pozostaje pomnożyć je i dodać:

I cząsteczkowo:

Pamiętajmy, że nawet jeśli reakcja zaczyna się w środowisku obojętnym, to w trakcie reakcji może się ono zmieniać – zarówno na kwasowe, jak i na zasadowe, a to drugie widzimy w powyższym przypadku. Oczywiście przenoszenie atomów tlenu z utleniacza na reduktor to nie jedyna możliwość utleniania. Pospolite jest także utlenianie przez usuwanie atomów wodoru z cząsteczki lub jonu reduktora. Dotyczy to przeważnie niesłusznie owianych złą sławą redoksów z udziałem związków organicznych, choć oczywiście utlenianie przez odwodornienie nie jest do nich ograniczone. Zaraz się przekonamy, jak proste potrafi być bilansowanie w takich przypadkach. Na początek utlenimy hydrazynę (diazan) N2H4, czyli H2N-NH2 do azotu przez zakwaszony roztwór dichromianu potasu. Zapiszmy substraty i produkty przemiany:
![]()
Reakcja biegnie w środowisku kwasowym, zatem bilansowanie prowadzimy używając kationów wodoru, oraz cząsteczek wody. Cząsteczka diazanu pozbywa się czterech atomów wodoru. Zatem załóżmy, że oddysocjowały cztery protony:

Jednakże aby ładunki zgadzały się stronami – musimy po prawej wprowadzić dodatkowe 4 elektrony (które „wyciągamy” z jonu N24-, który by powstał po oddysocjowaniu protonów):
![]()
mamy już równanie połówkowe utleniania. Teraz anion dichromianowy, który traci wszystkie atomy tlenu i przechodzi w proste aniony chromu(III).

bilansujemy ładunki:
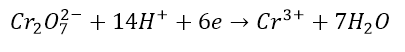
wyrównujemy liczbę wymienianych elektronów:

Dodajemy i redukujemy wyrazy podobne – otrzymujemy:
![]()
Przechodzimy do postaci cząsteczkowej:

Diazan zaliczamy do związków nieorganicznych, a przecież moglibyśmy zapisać analogiczne równanie, którym utleniamy eten C2H4 do C2 – gdyby oczywiście istniała taka odmiana alotropowa węgla zbudowana z cząsteczek dwuatomowych:
![]()
Lub po prostu możemy zapisać 2C po prawej i nie wnikać, którą odmianę węgla mamy na myśli, może to być węgiel bezpostaciowy. A tymczasem rozpatrzmy przytoczony na początku przypadek utleniania etanolu przez zakwaszony roztwór dichromianu(VI) potasu. Najpierw rozpisujemy substraty i produkty w postaci jonowej skróconej – skracamy jony, które się powtarzają i otrzymujemy:

Widzimy, że w reakcji cząsteczka alkoholu traci dwa atomy wodoru. Załóżmy, że oddysocjowały dwa kationy H+. Otrzymali byśmy dwuujemny anion CH3CHO2-, podczas gdy w równaniu mamy obojętną cząsteczkę aldehydu octowego CH3CHO. Zabieramy więc nadmiarowe elektrony i otrzymujemy cząsteczkę elektrycznie obojętną:
![]()
otrzymaliśmy w ten sposób połówkowe równanie utleniania. Przyjrzyjmy się chromowi. Anion dichromianowy przechodzi w dwa kationy chromu(III) tracąc przy tym 7 atomów tlenu. Kationów wodoru mamy pod dostatkiem, to wykorzystujemy je w tym celu i wyrównujemy ładunki elektronami:

Teraz otrzymujemy równanie połówkowe, które jest równaniem redukcji. Mamy już zestaw dwóch równań połówkowych, które trzeba odpowiednio pomnożyć, by wyrównać liczbę wymienianych elektronów:

Aby dostarczyć potrzebnej ilości elektronów muszą ulec utlenieniu 3 cząsteczki alkoholu. Po zsumowaniu otrzymujemy:

A teraz rozpatrzymy przypadek, w którym wymieniamy nie tylko atomy tlenu, ale także wodoru równocześnie: redukcję nitrobenzenu do aniliny. Z uzgodnieniem tego równania często mają problem nie tylko uczniowie. Spróbujmy uzgodnić reakcję redukcji nitrobenzenu cynkiem w obecności kwasu solnego. Zaczynamy od zapisania substratów i produktów:
![]()
Zapisujemy w postaci jonowej skróconej:

Spójrzmy, co dzieje się z nitrobenzenem: traci 2 atomy tlenu, ale zyskuje dwa atomy wodoru. Potrzeba więc czterech protonów, by związać tlen, oraz dwóch, które się przyłączą w jego miejsce do atomu azotu. Ładunek bilansujemy elektronami.
![]()
Otrzymaliśmy równanie redukcji. A cynk to już z górki:

Mnożymy równania i sumujemy:
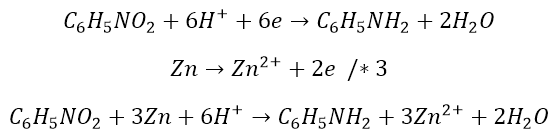
Przechodzimy do postaci cząsteczkowej:

I to wszystko. Pozostał jeszcze do omówienia przypadek, w którym nie cały substrat ulega redukcji/utlenieniu. Rozpatrzymy to na przykładzie roztwarzanie miedzi w roztworze kwasu azotowego:
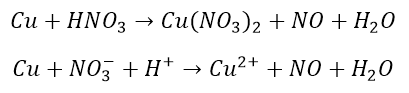
Utlenianie:

Redukcja:
![]()
Sumujemy:

Jednakże postać cząsteczkowa będzie nieco inna – musimy uwzględnić, że roztwór musi być elektrycznie obojętny, oraz że 8 kationów wodorowych zostało dostarczonych przez 8 cząsteczek kwasu, ale zaledwie dwie cząsteczki kwasu uległy redukcji, a pozostałe aniony reszty kwasowej równoważą ładunek dodatni powstałych kationów miedzi.
![]()
Na tym równaniu proponuję zakończyć naukę bilansowania i przejść do istoty rzeczy. Czy wszyscy zauważyli, że odkąd skupiłem się bilansowaniu metodą jonowo-elektronowego, to pomijając ich obecność w nazewnictwie, ani razu nie wspomniałem o stopniach utlenienia? O ich przypisywaniu atomom? O ich zmianie w trakcie reakcji? Pytanie dlaczego i czy to jest prawidłowe podejście? I dla wielu jest to kluczowe: czy mogę tak napisać na maturze?
Tak, to jest prawidłowe podejście. Musimy sobie uzmysłowić, że bilans jonowo-elektronowy wyróżniają trzy cechy:
1) nie posługuje się stopniem utlenienia,
2) pozwala zbilansować całe równanie bez konieczności posługiwania się bilansem materiałowym po ustaleniu współczynników przy utleniaczu i reduktorze,
3) bilansowanie ładunku pozwala określić, w którym równaniu połówkowym mamy do czynienia z redukcją, a w którym z utlenianiem,
Te trzy cechy odróżniają bilansowanie metodą jonowo-elektronową od bilansowania metodą elektronową, w której współczynniki dobiera się przypisując najpierw stopnie utlenienia i szukając atomów, które ów stopień formalnie zmieniły. Jak więc wyjaśnić to, że uczniowie nader często rozpoczynają bilansowanie metodą jonowo-elektronową od przypisywania stopni utlenienia? Wynika to przede wszystkim z nieodpowiedniego przedstawienia im zasad tego bilansowania, mieszania ze sobą dwóch różnych metod bilansowania przez podręczniki szkolne, a co za tym idzie – przez uczniów i nauczycieli z nich korzystających. W końcu jeszcze bilans elektronowy dominował przez kilkadziesiąt lat i jeszcze do niedawna, więc w wielu, a być może w większości przypadków określanie stopni utlenienia wynika z przyzwyczajenia. Dlaczego przypadek z redukcją nitrobenzenu jest kłopotliwy? Głównie dlatego, że uczniowie mają problem z przypisaniem stopni utlenienia atomowi azotu a cząsteczce nitrobenzenu oraz aniliny. Zazwyczaj wpadają w pułapkę i twierdzą, że w nitrobenzenie jest na V, bo grupa nitrowa pochodzi od kwasu azotowego(V). Jest to nie tylko błędnie przypisany stopień utlenienia, co i błędne podejście do bilansowania tą metodą. Zauważmy, że zbilansowaliśmy równanie poprawnie i nie wnikając w to, gdzie uległy zmianie stopnie utlenienia. Tak naprawdę reguły stosowania bilansowania metodą jonowo-elektronową są proste:
1) w środowisku kwasowym bilansujemy używając cząsteczek wody oraz protonów. Protony są akceptorem atomów tlenu lub donorem atomów wodoru, cząsteczki wody – donorem tlenu
2) w środowisku zasadowym bilansujemy używając cząsteczek wody oraz jonów, wodorotlenkowych, cząsteczki wody są akceptorami odrywanych atomów tlenu, a jony OH- – donorami tych atomów,
3) w środowisku obojętnym bilansujemy używając cząsteczek wody i protonów, lub cząsteczek wody i jonów wodorotlenkowych – sytuacja określa, którego zestawu należy użyć. W niektórych przypadkach można dopasować oba zestawy.
Często popełnianym błędem jest bilansowanie jednego równania połówkowego z użyciem protonów, a drugiego z użyciem anionów wodorotlenkowych, uzasadniając to tym, że przecież i tak się zobojętnią – ale czy na pewno się zbilansują po zsumowaniu równań połówkowych? Niekoniecznie.
Przyjrzyjmy się kolejnemu kłopotliwemu przypadkowi: utlenianie anionu tiosiarczanowego. Dlaczego kłopotliwego? Bo panuje pewna paranoja w kwestii przypisywania stopni utlenienia atomom siarki w tym jonie. Licealistom zazwyczaj wpaja się „jedynie słuszną” wersję, że jeden atom siarki jest na VI stopniu utlenienia, a drugi na –II. Czy na pewno? Stopień utlenienia jest pojęciem abstrakcyjnym – nie istnieje nigdzie poza naszymi umysłami. Jednakże przyglądając się budowie jonu tiosiarczanowego i definicji tego dziwacznego pojęcia przypiszemy centralnemu atomom siarki kolejno: IV (atom centralny) i 0 (ligand, czyli boczny). Rozpatrując jego struktury elektronowe można przypisać także V i –I – zgodnie z regułami przypisywania stopni utlenienia. Natomiast posiłkując się dodatkową umową, że tiosole to sole, w których co najmniej jeden atom tlenu został zastąpiony atomem siarki – przypisuje się VI (centralnemu), oraz –II (ligandowi, który zastępuje atom tlenu). Co prawda nie trzymamy się przyjętych zasad określania stopni utlenienia, ale wiadomo – umówiliśmy się na coś. W sumie jeśli coś jest w miarę proste, to czemu tego jakoś nie skomplikować? Będzie wyglądać na mądrzejsze dzięki temu. Ale czy to, w jaki sposób podzielimy elektrony walencyjne pomiędzy atomy w tym samym jonie ma wpływ na ostateczną postać równania reakcji? Przekonamy się. Załóżmy, że chcemy utlenić anion tiosiarczanowy do siarczanowego(VI) np. kwasem azotowym. Zapiszmy substraty i produkty.

Równanie:
![]()
A teraz rozpatrzymy to samo, ale posługując się stopniem utleniania – ustalimy liczbę wymienianych elektronów na podstawie zmiany stopnia utlenienia, a nie wyrównując ładunki. Dla ułatwienia zapiszemy wzór anionu tiosiarczanowego wg konwencji typowej dla anionów reszt kwasowych: atom centralny (kwasotwórczy), a następnie ligandy (atomy boczne) w kolejności alfabetycznej, wtedy wzór zamiast S2O32- zapiszemy jako SO3S2-. Najpierw wersja „maturalna”, a niżej kolejne, zgodne z definicją stopnia utlenienia.

Widzimy, że wszystkie równania są identyczne. Dokładnie taką samą liczbę, to jest osiem elektronów, otrzymamy z bilansu elektronowego. Dlaczego? Dlatego, że przypisując stopnie utlenienia nie zmieniliśmy stanu elektronowego jonu, tylko inaczej podzieliliśmy pomiędzy atomy te same elektrony. Nie ma to wpływu na współczynniki stechiometryczne, a nawet jeśli nie jesteśmy pewni, czy dobrze określiliśmy stopnie utlenienia, to przecież do zbilansowania równania metodą jonowo-elektronową nie są nam one potrzebne. Czy więc spór przed przystąpieniem do bilansowania o to, która wersja „jest maturalnie poprawna” jest uzasadniona, skoro metoda w ogóle nie posługuje się stopniem utlenienia i po to została stworzona, żeby się nim nie posługiwać? Zauważmy, jak wiele osób traci czas na upewnienie się co do rzeczy, która jest zbędna. Osoby przejmujące się maturą uświadamiam, że jeśli polecenie każe nam zbilansować równanie reakcji metodą jonowo-elektronową, to nie znaczy, że trzeba dodatkowo pisać stopnie utlenienia nad atomami – jeśli trzeba je przypisać, to jest to osobne polecenie i wcale nie musi dotyczyć równania reakcji, tylko jakiegoś konkretnego atomu w związku/jonie. Tylko w bilansie elektronowym trzeba się posługiwać stopniami utlenienia, ale ten obecnie nie jest preferowany. Zaś stopień utlenienia jest nieraz kwestią na tyle sporną, że jeśli nie ma wyraźnej potrzeby by go przypisywać, to lepiej po prostu zbilansować równanie, niż sobie nim zawracać głowę.
Zobaczmy jeszcze na inny przypadek, z którym mają problem kolejne roczniki uczniów i studentów: utlenienia pantasiarczku arsenu roztworem kwasu azotowego(V). Zapiszmy substraty i produkty:
![]()
I tutaj rozpoczyna się płacz i zgrzytanie zębów. No bo pojawia się regularnie zestaw pytań: jak to zbilansować? Jakie są stopnie utlenienia atomów w As2S5? Dlaczego mi nie wychodzi? Co więcej, to są kłótnie o to, która wersja stopni utlenienia jest poprawna (na maturze). Tymczasem zamiast się kłócić, to po prostu zbilansujmy to równanie. Rozbijamy na jony mocne elektrolity:

Środowisko jest kwasowe. Widzimy, że cząsteczka As2S5 uległa rozbiciu i utlenieniu. Znajdźmy więc odpowiednie równanie połówkowe i sumujemy:
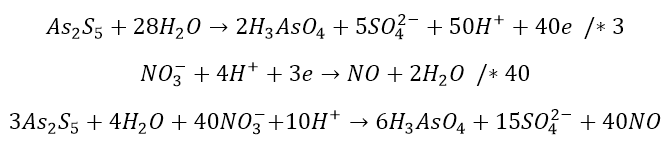
Przechodzimy do postaci cząsteczkowej:

Zanim przystąpiliśmy do bilansowania mieliśmy już podane, że woda jest substratem, ale bywają przypadki, że dopiero w bilansie okazuje się, że woda jest dodatkowym substratem lub produktem. Ponadto zdarza się, że dopiero bilans wskazuje, że reakcja wymaga środowiska zasadowego lub kwasowego. Np. zazwyczaj spodziewamy się wody w produktach, podczas gdy bilansując okaże się, że woda jest dodatkowym substratem.
Przebrnęliśmy – mam nadzieję, że ten artykuł rozjaśni wiele kwestii, ale przede wszystkim – ułatwi bilansowanie reakcji i pozwoli prawidłowo posługiwać się czy to bilansem jonowo-elektronowym, czy to elektronowym. Tym bardziej, że bilansowanie metodą jonowo-elektronowy powstało po to, by sobie życie ułatwić, a w praktyce zamiast tego ułatwienia to jeszcze bardziej sobie je komplikujemy, próbując błędnie i zbędnie wprowadzaćreguły jednej metody do drugiej metody.
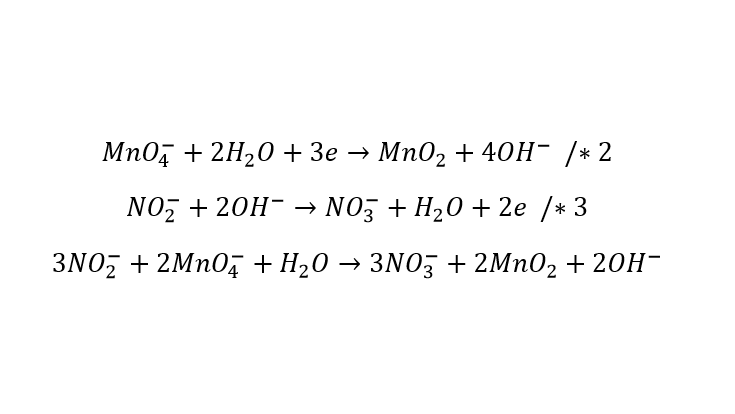
Pozjadałeś dwójki przy Cr(3+) w reakcji etanolu z dichromianem.
Dzięki, poprawię 😉
Zapis cząsteczkowy manganu w zasadowym jest żle zbilansowany.
zerknę i poprawię 🙂
Czy słabe elektrolity typu H2S rozpisujemy na jony przy metodzie elektronowo-jonowej?
Dzień dobry, nie.