Biofilm bakteryjny – co musimy o nim wiedzieć?

Biofilm to złożona struktura utworzona z komórek jednego lub kilku gatunków drobnoustrojów (bakterii, grzybów, pierwotniaków) otoczonych warstwą zewnątrzkomórkowej macierzy polisacharydowej. Taka struktura nazywana jest również błoną biologiczną (ang. biological membrane). Biofilm może przylegać zarówno do powierzchni biotycznych (komórek i tkanek ludzkich), jak i abiotycznych (implanty i urządzenia medyczne).
Mikroorganizmy mogą występować w naturze w postaci planktonicznej, czyli zbioru rozproszonych komórek bakteryjnych bądź tworzyć skupiska w postaci biofilmu (ta forma stanowi około 95%).
Drobnoustroje wchodzące w skład biofilmu charakteryzuje wzrost inwazyjności oraz zdolność do wywoływania groźnych zakażeń, zwłaszcza w warunkach szpitalnych. Wytwarzają one biofilm na powierzchniach biomateriałów medycznych – implantów ortopedycznych, różnego typu cewników, sztucznych zastawek serca, szwów, rozruszników serca oraz soczewek kontaktowych, a także bytują w miejscach o dużej wilgotności i dobrym napowietrzeniu, takich jak umywalki, nawilżacze powietrza, klimatyzatory.
Właściwości biofilmu i wpływ na lekooporność bakterii
Warstwa nierozpuszczalnych polimerów otaczająca drobnoustroje w strukturze biofilmu ułatwia adhezję bakterii do podłoża oraz stanowi barierę ochronną zabezpieczającą mikroorganizmy przed niekorzystnym wpływem czynników środowiskowych (np. wysychaniem, promieniowaniem UV, niedoborem substancji odżywczych). Bakterie zasocjowane w postaci biofilmu charakteryzują się także zmniejszoną wrażliwością na działanie środków dezynfekcyjnych oraz różnych grup antybiotyków. Ponadto biofilm skutecznie chroni komórkę bakteryjną przed licznymi mechanizmami obronnymi organizmu gospodarza.
Aktywność wielu dostępnych związków przeciwdrobnoustrojowych w stosunku do biofilmu jest znacznie ograniczona. Warstwowa budowa biofilmu oraz obecność macierzy polisacharydowej utrudnia penetrację wielu związków do wnętrza struktury. Drobnoustroje położone w głębszych warstwach posiadają odmienny profil fizjologiczny i metaboliczny – maleje ich tempo wzrostu i są przystosowane do warunków beztlenowych. W trakcie dojrzewania biofilmu może także dojść do aktywacji genów kodujących enzymy rozkładające leki lub kodujących białka wypompowujące związki z komórek bakteryjnych.
Ważnym aspektem jest również rosnąca i powszechna wielolekooporność szczepów bakteryjnych istotnych z klinicznego punktu widzenia. W środowisku powszechnie występują biofilmy mieszane, czyli utworzone przez kilka gatunków mikroorganizmów, które w procesie horyzontalnego transferu genów przekazują sobie nawzajem determinanty oporności na leki.
Wykazano, że stężenie terapeutyczne niektórych antybiotyków jest ponad 100-krotnie większe dla bakterii tworzących biofilm w porównaniu do bakterii żyjących poza nim. Nieprawidłowo przeprowadzona antybiotykoterapia może być przyczyną rozwoju subpopulacji bakteryjnych komórek przetrwałych (tzw. persister cells), które po zakończeniu leczenia umożliwiają odnowienie populacji biofilmu.
Biofilm jako czynnik chorobotwórczości
Biofilm jest ważnym problemem medycyny. Eksperci z amerykańskiego Centrum Zapobiegania i Zwalczania Chorób (CDC) szacują, że 65% szpitalnych zakażeń bakteryjnych związana jest z obecnością biofilmów na powierzchni stosowanych materiałów medycznych. Infekcje związane z biofilmem są przyczyną także licznych komplikacji terapeutycznych, gdyż przechodzą w stan przewlekły i nawracają po wyleczeniu.
Zdolność produkcji biofilmu wykazuje szerokie spektrum drobnoustrojów. Do najpowszechniejszych szczepów tworzących biofilm zalicza się:
- Staphylococcus aureus
- Staphylococcus epidermidis
- Enterococcus faecalis
- Streptococcus spp. grupa viridans
- Escherichia coli
- Klebsiella pneumoniae
- Proteus mirabilis
- Pseudomonas aeruginosa.
Biofilm gronkowcowy odpowiedzialny jest za rozwój między innymi infekcyjnego zapalenia wsierdzia, zapalenia ucha środkowego oraz zakażenia kości. Szacuje się, że odpowiada za ok. 50–70% infekcji związanych z tworzeniem się biofilmu na implantach sercowo-naczyniowych. Natomiast pałeczki Gram-ujemne są najczęstszymi czynnikami etiologicznymi zakażeń układu moczowego oraz infekcji związanych z wykorzystaniem cewników urologicznych. Ryzyko infekcji dróg moczowych ściśle wiąże się z czasem cewnikowania i wzrasta każdego dnia o 5%.
Zdolność do produkcji biofilmu to cecha naturalna wszystkich bakterii tworzących mikroflorę skóry i błony śluzowej jamy ustnej (tzw. płytka nazębna). Jednak nadmierne wytwarzanie biofilmu o nieprawidłowym składzie przez paciorkowce jest przyczyną dwóch najczęściej występujących chorób jamy ustnej – próchnicy zębów oraz stanu zapalnego dziąseł.
Przewlekłe zakażenia dróg oddechowych w przebiegu mukowiscydozy powiązane są z obecnością biofilmów bakteryjnych. Bakterie namnażają się w zmienionym śluzie zalegającym w płucach, tworząc mikrokolonie oraz biofilm. Częstym czynnikiem etiologicznym zakażenia jest P. aeruginosa wytwarzający zewnątrzkomórkowo polisacharydy takie jak psl, pel oraz alginian. Wszystkie wyżej wymienione elementy są głównymi składnikami biofilmu. Alginian jest głównym składnikiem otoczki bakteryjnej odpowiadającej za śluzowy fenotyp kolonii jedynie u szczepów chorobotwórczych, izolowanych od pacjentów z mukowiscydozą.
Biofilm może być także związany z infekcjami skóry, w tym z infekowaniem miejsc pooparzeniowych czy ran pooperacyjnych. U diabetyków chronicznemu owrzodzeniu stopy cukrzycowej najczęściej towarzyszy powstawanie biofilmów mieszanych. Ponadto u diabetyków wykrywano biofilm w blaszkach miażdżycowych tętnic, co jest głównym czynnikiem wpływającym negatywnie na postęp choroby.
Wrotami infekcji w ludzkim ciele mogą być nie tylko tkanki o przerwanej ciągłości, jak w przypadku cewników, ale i warstwa nabłonka. Przykładem może być nabłonek przedni rogówki ludzkiego oka oraz infekcje u osób stosujących soczewki kontaktowe. U 20 osób cierpiących na bakteryjne zapalenie rogówki badaniu poddano stosowane przez nich soczewki kontaktowe oraz pojemniki do ich przechowywania. Najczęściej biofilm występował na pojemnikach, bo aż u 17 osób, natomiast do zainfekowania soczewek doszło u 11 osób. Podobnie było z gęstością powstałego biofilmu, który widocznie gęstszy był na powierzchni pojemników. Wykazano również brak istotnej różnicy między obecnością biofilmu, a higieną użytkowania soczewek przez badanych. Spośród izolowanych mikroorganizmów najczęściej oznaczano pałeczki, m.in. Pseudomonas aeruginosa, znajdowano także różne drożdżaki i strzępki grzybów.
W jaki sposób formuje się biofilm?
Budowa biofilmu bywa różnorodna i zależy od kilku czynników, głównie od warunków panujących w danym środowisku oraz własności tworzących go drobnoustrojów. Powstawanie biofilmu jest procesem złożonym, ściśle kontrolowanym, obejmującym kilka etapów:
- etap 1 – adhezja odwracalna
Dużą rolę w procesie kolonizacji powierzchni przez bakterie odgrywają ich struktury zewnętrzne takie jak fimbrie czy rzęski, a także struktura, do której adherują oraz wszelkie jej uszkodzenia i chropowatości. Warunkiem niezbędnym do adhezji jest kondycjonowanie powierzchni, czyli pokrycie jej warstwą substratów stanowiącą dla mikroorganizmów pożywkę – mogą to być białka, glikoproteiny lub lipidy. Adhezja odwracalna nie zapewnia trwałości biofilmu, może być on łatwo usunięty za pomocą środków fizycznych i chemicznych.
- etap 2 – adhezja nieodwracalna
Dochodzi do wytworzenia specyficznych wiązań między zasiedlaną powierzchnią a występującymi na powierzchni komórek adhezynami, Podstawową rolę w tym procesie odgrywają polimery zewnątrzkomórkowe (EPS) tworzące tzw. glikokaliks. Początkowo podłoże pokrywa się pojedynczą warstwą komórek drobnoustrojów. Obserwowana jest synteza i wzmożone wydzielanie biopolimerów zewnątrzkomórkowych, a powstające otoczone śluzem skupisko stymuluje adhezję innych mikroorganizmów.
- etap 3 – dojrzewanie biofilmu
Następuje namnażanie drobnoustrojów i ich stopniowe różnicowanie. W komórkach dochodzi do aktywacji lub hamowania ekspresji określonych genów w sposób optymalny dla przeżycia.
Dojrzała forma biofilmu otoczona jest grubą warstwą glikokaliksu, do którego adsorbowane są substancje mineralne, związki organiczne i komórki innych drobnoustrojów. Bakterie bytujące we wnętrzu biofilmu narażone są na ograniczenie dostępu tlenu, z tego też względu zmienia się ich profil metaboliczny.
- etap 4 – dyspersja
W pełni ukształtowany biofilm osiąga tzw. krytyczną grubość i stopniowo przestaje utrzymywać istniejącą formę. Następuje wówczas migracja komórek z peryferyjnych części dojrzałego biofilmu do otoczenia, natomiast oderwane elementy rozpoczynają proces kolonizacji nowych powierzchni.
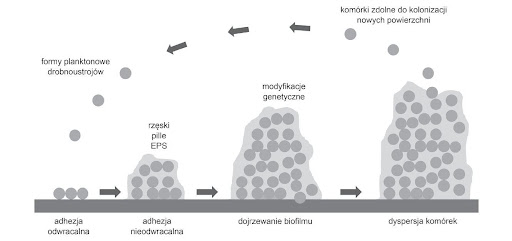
Ryc. Etapy powstawania biofilmu [Maciejewska i wsp.]
Zjawisko quorum sensing
Ekspresja różnorodnych profili chorobotwórczości wśród mikroorganizmów tworzących biofilm jest związana z mechanizmem wyczuwania liczebności (ang. quorum sensing, QS). Jest to system międzykomórkowej komunikacji bakteryjnej wykorzystujący chemiczne cząsteczki sygnalizacyjne – autoinduktory, których zadaniem jest regulacja ekspresji wielu genów w odpowiedzi na liczebność populacji drobnoustrojów w danym środowisku (szacowanie własnego zagęszczenia). QS koordynuje procesy fizjologiczne i metabolicznie w obrębie biofilmu, w tym proces formowania oraz stabilizacji biofilmu, a także odpowiada za ekspresję określonych czynników patogenności.
Strategie zapobiegania tworzenia się biofilmu
Aby ograniczyć ryzyko rozwoju biofilmu na powierzchni biomateriałów medycznych poszukiwane są nowe sposoby profilaktyki wyżej wymienionych infekcji. Strategie te zakładają możliwość modyfikacji powierzchni materiałów celem ograniczenia adhezji drobnoustrojów oraz ingerencję w początkowe fazy rozwoju biofilmu.
- Celowanie w początkową fazę powstawania biofilmu
- zastosowanie związków niskocząsteczkowych (Small Molecules) – związki niskocząsteczkowe, poprzez inhibicję genów odpowiedzialnych za ekspresję czynników wirulencji, powodują także zahamowanie formowania się biofilmów.
- ingerencja w quorum sensing – syntetyczne cząsteczki sygnałowe (analogi bakteryjnych autoinduktorów) łączą się z receptorami bakteryjnymi i hamują komunikację pomiędzy drobnoustrojami tworzącymi biofilm
- zastosowanie przeciwciał wiążących adhezyny błony komórkowej mikroorganizmów
- wykorzystanie szczepu niepatogennego do wytworzenia biofilmu na materiale wprowadzonym do organizmu pacjenta (metoda ta jest rozpatrywana przede wszystkim pod kątem zapobiegania infekcjom układu moczowego
2. Modyfikacja biomateriałów w celu zwiększenia ich odporności na adhezję drobnoustrojów
2.1. materiały antyadhezyjne
- wykazano, że mikroorganizmy łatwiej kolonizują cewniki wykonane z lateksu lub elastomerów silikonowych, wykorzystanie poliuretanu lub 100% silikonu znacznie utrudnia przyleganie komórek
- cewniki lateksowe pokryte hydrożelem oraz cząsteczkami srebra wykazywały zmniejszoną o 47% podatność na inwazję bakteriami
- powlekanie fragmentów cewników za pomocą nanocząstek fluorku itru pozwala ograniczyć adhezję i wpływa na redukcję dojrzałego biofilmu
- skuteczne jest także stosowanie implantów o powierzchni mniej chropowatej (mniejsza warstwa kondycjonująca do kolonizacji) oraz o średnicy porów poniżej 15-25 nm
2.2. powłoki bakteriobójcze/bakteriostatyczne
Materiały biomedyczne mogą być powlekane antybiotykami oraz metalami szlachetnymi. Wykazano, że powierzchnie tytanowe implantów kowalencyjnie związane z wankomycyną skutecznie hamują rozwój biofilmu S. epidermidis.
Metody eradykacji biofilmu
Infekcje bakteryjne związane z kolonizacją materiałów wszczepiennych stają się coraz trudniejsze do wyleczenia, a także powodują powstanie zakażeń uogólnionych. Prowadzone są także badania nad próbą zniszczenia powstałego już biofilmu.
Istnieją 3 metody eradykacji biofilmu bakteryjnego:
- metody fizyczne (ograniczają się głównie do usuwania biofilmu z powierzchni nieożywionych)
- mechaniczne niszczenie poprzez szorowanie lub skrobanie
- wysoka temperatura (95°C 100 min)
- cykl trzykrotnego zamrażania (–12°C) i rozmrażania
- fale ultradźwiękowe (sonifikacja)
- terapia fotodynamiczna – zastosowanie związków fotouczulających, które po aktywacji światłem wykazują działanie cytotoksyczne poprzez generowanie reaktywnych form tlenu
2. metody biologiczne
- fagoterapia
- enzymy skierowane wobec macierzy polisacharydowej, np. dyspersyna B
- peptydy przeciwdrobnoustrojowe (AMP) – wykazują szeroki zakres działania na komórki drobnoustrojów – mogą hamować bądź modyfikować syntezę ściany komórkowej, wpływają także na funkcjonowanie komórki poprzez hamowanie procesów replikacji, transkrypcji, translacji, a także inhibicji enzymatycznych funkcji białek. Wady stosowania AMP to m.in. trudność w zastosowaniu ich jako powłoki, wrażliwość na pH oraz potencjalna toksyczność. Istotne także są wysokie koszty syntezy.
3. metody chemiczne – zastosowanie substancji utleniających, które powodują degradację budowy przestrzennej biofilmu
- chlor i jego związki
- formaldehyd
- czwartorzędowe sole amoniowe
Bibliografia:
- Biofilm bakteryjny jako przyczyna zakażeń układu moczowego – mikroorganizmy patogenne, metody prewencji i eradykacji, Ostrowska K. i wsp., Postepy Hig Med Dosw, 2013; 67: 1027-1033
- Biofilm i metody jego eradykacji, Szlauer W. i wsp., Postepy Hig Med Dosw, 2019; 73: 397–413
- Nowoczesne metody zwalczania biofilmu bakteryjnego, Maciejewska M. i wsp., Post. Mikrobiol., 2016, 55, 1, 3–11
Autorzy:
Agnieszka Góra
Justyna Pieczonka-Prochownik