H2SO4 – kwas mocny, czyli jaki?
Tym razem do napisania artykułu skłoniły mnie dwie wzajemnie sprzeczne odpowiedzi dotyczące… tego samego zagadnienia. Bo tak się składa, że to o czym tym razem napiszę, to jedno z powtarzających się pytań jakie dostaję i sam znajduję w grupach maturalnych. Pytanie dotyczy właściwości kwasu siarkowego (VI), czyli H2SO4. Postaram się też odpowiedzieć na te pytania i podać przyczyny sprzeczności. Jakie to pytania? Pozwólcie, że wyjaśnię za moment.
Przejdźmy do naszego bohatera.
Gdyby zapytać o nazwę związku o wzorze H2SO4, to zarówno uczeń, student, czy nauczyciel chemii odpowie, że kwas siarkowy(VI). Chemik często odpowie, że kwas siarkowy, już nie dodając, który stopień utlenienia przypisujemy siarce – po prostu się tak utarło wśród chemików. Nie spotkałem chemika, który powiedziałby inaczej niż: kwas siarkowy lub kwas siarkowy(VI). Ponadto dowiemy się, że to kwas mocny – czyli mocny elektrolit. W równaniach reakcji w zapisie jonowym zamiast H2SO4 piszemy lub widzimy w książkach zwykle: 2H+ + SO42- w zapisie pełnym i po prostu 2H+ w zapisie skróconym. Bo to mocny elektrolit. Na pytanie jaki odczyn ma czysty kwas siarkowy(VI) większość odpowiada, że kwasowy. A na pytanie o pH, to już w ogóle: ło Panie…
A jednak wszystko co napisałem wyżej i co jest przekonaniem funkcjonującym w chemicznej społeczności, łącznie z nazwą, jest nieprawdą.
O kwasie siarkowym uczymy się i mówimy bardzo źle, a to skutkuje: 1) zadaniami sprzecznymi ze sobą w różnych źródłach, z których korzystają uczniowie i studenci, 2) pytaniami, bo niektórym coś tutaj nie pasuje… To złe uczenie wynika głównie z dziurawości materiału, bo, jak powtarzam, stosowany od dziesiątek lat kanon edukacyjny nie pracuje dobrze i nic nie da ciągłe wydawanie nowych (ale czy lepszych?) podręczników czy zbiorów, póki nie sięgnie się do sedna problemu. Takie tradycyjne przedstawianie utrudnia zrozumienie nawet prostych rzeczy i jest źródłem błędnych przekonań nawet wśród osób po studiach chemicznych. Czyli także wśród autorów podręczników i zbiorów zadań. A przecież to chodzi o krew przemysłu! A jednak o tej krwi myślimy bardzo źle po tym, co oferuje nam system edukacji.
Od czego by należało rozpocząć naukę o kwasie siarkowym(VI)? Od samej nazwy. Związek chemiczny o wzorze H2SO4 nie jest kwasem. Nie jest. Od samego początku nasze skorupki nasiąkają błędnym przekonaniem. Nazwa kwas siarkowy(VI), choć dopuszczona przez IUPAC, nie jest nazwą systematyczną. Nie jest nazwą właściwą. Jest spuścizną alchemii. Do dziś niewykorzenionej alchemii, bo do dziś edukacje chemiczną zaczynamy od nasączania alchemią skorupek za młodu. Niczym chwast w trawniku. W alchemicznym ujęciu kwasem nazywano substancję, która miała smak kwaśny. Ale dodajmy, że alchemicy kwasem nazywali w większości nie czyste związki, tylko ich wodne roztwory, z którymi pracowali. Tak jak np. kwas z ogórków kiszonych itp. A nawet jeśli mówimy o czystych związkach a nie ich wodnych roztworach, to nie da się smaku substancji sprawdzić na sucho – bo ślina w naszych ustach to także wodne środowisko. Mamy tutaj przykład nazewnictwa archaicznego, ale tak silnie zakorzenionego, że do dziś używanego i wpajanego w szkołach od początku, pomimo tego, że jest jednym ze źródeł powszechnych herezji. Na alchemicznym podejściu oparta jest zresztą teoria Arrheniusa, która dawno powinna trafić do lamusa, a to od niej rozpoczynamy przygodę z kwasami i zasadami w szkole. O tej teorii powinno się mówić wyłącznie w kontekście ciekawostki historycznej. Zresztą tak naprawdę teoria zaproponowana przez Arrheniusa przeszła do lamusa (rupieciarni) – kiedy to 01.01.1923 J. N. Broensted, a 19.01.1923 T. M. Lowry oficjalnie i niezależnie od siebie opublikowali swoje propozycje, znane i używane do dziś jako teoria kwasów i zasad protonowych, czyli tzw. teoria Broensteda-Lowry’ego. Jeszcze w tym samym roku szerszą teorię zaproponował G.N. Lewis. Obie teorie te są używane do dziś. Na czym polega ich doniosłość, że nie zostały wyparte pomimo upływu czasu? Nie tylko na tym, że wyjaśniły zasadowy odczyn wodnego roztworu amoniaku, albo reakcję tlenków litowców z wodą. Ich doniosłość polegała na zerwaniu z alchemią. Tak, to pierwsze porządnie opracowane teorie, które odcięły pojęcie kwasu i zasady od alchemii.
Na czym polega to odcięcie się? Na tym, że to pierwsze koncepcje, których autorzy zauważyli, że wbrew temu co uporządkował (albo raczej: próbował uporządkować) Arrhenius opierając się na pojęciach używanych przez alchemików, pojęcie kwasu i zasady nie są pojęciami absolutnymi. Podobnie jak to, czy coś jest utleniaczem, czy reduktorem, zależy od tego jaką rolę pełni w danej reakcji, tak samo to czy coś jest kwasem czy zasadą zależy od reakcji, w której bierze udział. Alchemicy nazwali coś kwasem na podstawie tego, czym dysponowali, a wtórował temu Arrhenius. Natomiast Broensted i Lowry stwierdzili, że to nie są pojęcia absolutne i te pojęcia odcięli od wcześniejszych przekonań. Nic samo z siebie nie jest kwasem, albo zasadą. Samo z siebie może być najwyżej i kwasem, i zasadą równocześnie. Ot, woda w reakcji autodysocjacji jest i kwasem, i zasadą.

Ze względu na równe stężenie formy kationowej i anionowej odczyn czystej wody jest obojętny. Analogicznie w przypadku ciekłego amoniaku:

Czy metanolu:

I wielu innych związków ulegających autodysocjacji. A co z naszym H2SO4? On także dysocjuje. Ale nie tak, jakby wynikało z teorii Arrheniusa, bo sam z siebie kwasem nie jest. Ulega dysocjacji (autodysocjacji) z przeniesieniem protonu, a jedna cząsteczka w akcie reakcji jest kwasem, a druga zasadą.

Choć to nie jest jedyna równowaga ustalająca się w czystym kwasie, to jednak ta konkretna nas interesuje. I tutaj pierwsza niespodzianka, bo czysty (100%) H2SO4 nie dość, że nie jest kwasem, to jeszcze NIE JEST mocnym elektrolitem. Jest to reakcja zachodząca w niedużym stopniu, a jej równowagę opisuje… iloczyn jonowy. Tak samo jak w przypadku wody! Dla H2SO4 w 25 °C wynosi on 2,7·10-4. W końcu, gdyby czysty H2SO4 był całkowicie zdysocjowany, to cieczą w temperaturze pokojowej by nie był. I byłby związkiem jonowym, a nie kowalencyjnym. Jaki jest odczyn 100% H2SO4? OBOJĘTNY. A dlaczego? Bo wszystkie czyste substancje mają odczyn obojętny ze względu na równe stężenia form kationowych i anionowych odpowiedzialnych za odczyn. Na tym polega też obojętność wody. I tak jak w wodzie kwasem jest np. HCl, generujący jony H3O+, to w ciekłym (skroplonym) amoniaku ten HCl także będzie kwasem, bo wygeneruje jony NH4+ odpowiedzialne za kwasowy odczyn w NH3. W ciekłym amoniaku kwasami są także sole amonowe (zauważmy, że rozpuszczając HCl w ciekłym NH3 (nie mylić z wodą amoniakalną) otrzymujemy to samo co po rozpuszczeniu NH4Cl w ciekłym amoniaku). Zasadą w wodzie są jony OH–, w ciekłym amoniaku jony NH2–, a w H2SO4 jako rozpuszczalniku za zasadowy odczyn odpowiadają jony HSO4–. Odpowiednikiem KOH w wodzie jest więc KHSO4 rozpuszczony w H2SO4. Nasz „kwas siarkowy(VI)” może być też zasadą – bo nie jest kwasem absolutnym! W reakcji z odpowiednim związkiem, np. kwasem heksafluoroantymonowym HSbF6:

A HNO3, czyli „kwas” azotowy(V)? Jest zasadą wobec H2SO4, bo przypominam, że to nie jest pojęcie absolutne, tylko zależne od tego jaką reakcję rozpatrujemy. Dochodzimy do sedna. Czy nazwa kwas siarkowy(VI) jest poprawna? Nie. Jest to nazwa zakorzeniona, tradycyjna. Chwast pielęgnowany. Chemicznie H2SO4 jest niczym innym jak siarczanem(VI) wodoru. Ale to także nie jest systematyczna nazwa. Jak go więc nazwać właściwie (systematycznie)? Dihydroksy-λ6-sulfanodion. Brzmi skomplikowanie i zupełnie inaczej, niż jesteśmy przyzwyczajeni, prawda? I nie pojawia się słowo kwas w nazwie. W ogóle czysty H2SO4 jako rozpuszczalnik to ciekawa chemia, i może kiedyś o tym napiszę. A teraz przejdźmy do rzeczy, które powszechnie są uważane o kwasie siarkowym(VI).
Po pierwsze, o samym kwasie uczymy się źle. Nieprawdziwe informacje są podawane przez podręczniki nawet jeśli chodzi o jego mieszalność z wodą! Smutno się człowiekowi robi, gdy czyta, że ktoś z naukowym stopniem z chemii pisze, że maksymalne stężenia H2SO4 w wodzie wynosi 96%, a dla HNO3 68%. Nie. To ograniczenie wynika z metody produkcji i tworzenia mieszanin azeotropowych z wodą, czego nie będę tutaj omawiał. A nie z rozpuszczalności. Zarówno H2SO4 jak i HNO3 to związki, które bez ograniczeń mieszają się z wodą w temperaturze pokojowej i wyższych od niej. Zatem możemy mieć mieszaninę o składzie np. 90% HNO3 i 10% wody, albo 99% H2SO4 i 1% wody.
A co z tym, że to mocny elektrolit? Nasz H2SO4 staje się prawdziwym kwasem w odpowiednim rozpuszczalniku. Może nim być woda – najdostępniejszy na Ziemi rozpuszczalnik. I tutaj trafiamy na kolejne sedno problemu. To właśnie na podstawie zachowania w wodzie mówimy, że H2SO4 czy HCl są mocnymi elektrolitami. Tak po prostu przyjęto. O tym że H2SO4 jest mocnym elektrolitem mamy prawo powiedzieć tylko wtedy, gdy omawiamy jego wodny roztwór, ew. roztwór w innym rozpuszczalniku sprzyjającym dysocjacji. To w wodnym roztworze H2SO4 jest mocnym elektrolitem, a nie sam z siebie jako związek. Wszelakie stałe dysocjacji kwasowej czy zasadowej znane z tablic dotyczą rozcieńczonych wodnych roztworów związków, i to jeszcze w 25 °C. NIE MOŻNA TYCH WARTOŚCI I ZACHOWANIA W WODNYCH ROZTWORACH ODNOSIĆ ANI DO ROZTWORÓW WODNYCH O DUŻYM STĘŻENIU, ANI CZYSTYCH SUBSTANCJI. Tymczasem zobaczmy, na jakie treści skazani są uczniowie, a często i studenci:
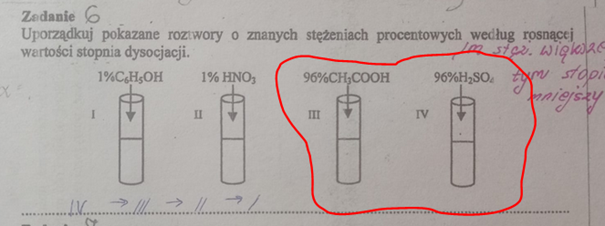
Rozcieńczona woda amoniakalna i ciekły amoniak to zupełnie różne rzeczy. Tak samo CH3COOH a rozcieńczony wodny roztwór CH3COOH to zupełnie różne rzeczy. Podobnie H2SO4 i układy H2SO4-H2O. W wodzie rozpatrujemy Ka dla kwasu octowego czy Kb dla amoniaku. Ale w czystym (100%) kwasie octowym rozpatrujemy jego autodysocjację i iloczyn jonowy dla CH3COOH, który ma całkowicie inną wartość niż Ka: 2,5*10-13 wobec stałej dysocjacji w wodzie równej 1,75*10-5. W roztworach o dużych stężeniach, np. 80% CH3COOH w wodzie autodysocjacja zachodzi równolegle z dysocjacją w wodzie i ani Ka, ani iloczyn jonowy nie jest miarodajny. Tablicowe wartości Ka czy Kb są określone dla wodnego środowiska i tylko wtedy pracują – póki woda jest środowiskiem dla procesów zachodzących w roztworze, tzn. póki otoczeniem drobin w roztworze są cząsteczki wody, a nie cząsteczki i jony substancji rozpuszczonej. Możemy powiedzieć, że CH3COOH jest bardziej zdysocjowany w roztworze o stężeniu 0,05 mol/dm3 niż w roztworze o stężeniu 0,1 mol/dm3. Ale nie możemy porównywać kwasu o stężeniu 1% z 96%! To nie jest wodne środowisko, w którym pracuje Ka czy Kb! Tak więc to co mówienie o H2SO4 jako elektrolicie mocnym dotyczy wyłącznie rozcieńczonych wodnych roztworów. Dwa, pH wodnego roztworu o st. 0,05 mol/dm3 nie wynosi 1, jak chcą niektóre podręczniki, które dysocjację H2SO4 w wodzie widzą tak:
![]()
Tylko wynosi 1,24, co wynika z faktu, że zachodzi ona etapowo. I tylko na podstawie pierwszego etapu stwierdzamy, że to jest kwas mocny.
![]()
Ale anion HSO4– jest drobiną, która w wodzie jest kwasem średniej mocy (Ka=0,0102).
![]()
Drugi etap dysocjacji zachodzi w wodnym roztworze o st. 0,05 mol/dm3 w 25 °C zaledwie w 15%! A co dopiero gdy zwiększymy stężenie roztworu?
Pikanterii sprawie dodaje fakt, że kwasem siarkowym powinno się nazywać roztwory H2SO4 w wodzie, a nie sam H2SO4. Tak jak kwasem solnym jest wodny roztwór HCl, a nie sam HCl. Octem nazywamy wodny roztwór CH3COOH, a nie sam CH3COOH – który z jakiegoś powodu zwiemy kwasem octowym (i wracamy do początku tej historii). Taki brak rozróżnienia w nazwie pomiędzy czystym związkiem a jego roztworem, potęguje błędne myślenie.
Zauważmy, że mówimy o kwasie rozcieńczonym i stężonym, nazywając kwasem siarkowym(VI) mieszaniny H2SO4 z H2O. To samo dotyczy HNO3 i innych „tradycyjnych” substancji, z etanolem włącznie, gdyż alkoholem nazywamy nie tylko C2H5OH, ale też jego mieszaniny z wodą. Zauważmy niekonsekwencję w nomenklaturze: zasadą sodową nie jest NaOH, tylko wodny roztwór NaOH i mamy wyraźne rozdzielenie pojęć: zasada i wodorotlenek – nawet od uczniów wymaga się odróżniania tych pojęć. Dlaczego dla kwasów nie postąpiono analogicznie i konsekwentnie? Dodam, że to nie jest jedyna niekonsekwencja, która rodzi problemy. Część tych niekonsekwencji dotyczy ogólnie nomenklatury, ale część – wyłącznie polskiej nomenklatury i pewne problemy dotyczą tylko polskiej edukacji. Ale tym innym razem napiszę. Z tego też powodu kilka razy napisałem, że czysty oznacza 100% kwas, żeby było to jasne, że chodzi o konkretny związek chemiczny, a nie jego mieszaninę z wodą. Nie miałbym tego problemu z NaOH, bo byłby albo wodorotlenek sodu, albo zasada sodowa, zależnie od tego o czym piszę…
Moc kwasu zależy od rozpuszczalnika w jakim się znajdzie. I tak HNO3 to kwas mocny, jak się uczymy. Ale czy zawsze? Nie. Jest mocnym kwasem w wodzie! Ale już rozpuszczony w etanolu jest kwasem słabym, porównywalnym mocą z kwasem mrówkowym w wodzie. To samo dotyczy H2SO4. Stwierdzono, że H2SO4 jest kwasem mocnym w acetonitrylu czy w sulfotlenku dimetylu, ale już jon HSO4– – kwas średniej mocy w wodzie jest kwasem bardzo słabym we wspomnianych rozpuszczalnikach organicznych i dysocjacja jonów HSO4– jest w układach H2SO4-acetonitryl czy H2SO4-sulfotlenek dimetylu pomijalna.
Czym skutkuje tak wiele niedopowiedzeń + mentalne trwanie w tradycji alchemicznej? W tym, że wiele uczniów czy studentów myśli, że H2SO4 to związek w pełni zdysocjowany, bo to mocny elektrolit. Błędnie bierze kowalencyjny (cząsteczkowy!) związek za jonowy. Wiele razy spotkałem się z tym, także wśród swoich kursantów, że każąc wybrać związki jonowe część ludzi zaznacza HCl i H2SO4. A dlaczego? Myślę, że odpowiedź jest jasna. Spójrzmy na fragment raportu CKE o maturze w 2021 roku:

16% to niewiele… Ten HCl to nie przypadek. Gdyby był tam jeszcze H2SO4, to też część ludzi by zaznaczyła. Zwróćmy uwagę, że problem dotyczy nie tylko H2SO4 czy HNO3, ale np. też kwasów karboksylowych. Nazywamy je kwasami, bo wynika to z tradycji. Do tego dodajmy kwasy sulfonowe, sulfinowe, fosfonowe itd… Ponadto kto dziś pamięta, że np. fenol dawniej nazywano kwasem karbolowym, co wynika z kwasowego odczynu karbolu – roztworu fenolu w wodzie. Albo kwas askorbinowy, którego cząsteczka nie ma żadnych grup, które na pierwszy rzut oka kojarzymy z kwasami, a jednak nazywamy go kwasem, bo w wodzie daje kwasowy odczyn.Kwasem jest w wodzie (innych rozpuszczalnikach), a nie sam z siebie! Znowu ta alchemia.
To teraz wróćmy do pytań, o którym pisałem na początku: „Dlaczego H2SO4 nie tworzy wiązań wodorowych, skoro ma atomy wodoru z związane z silnie elektroujemnym atomem tlenu?” i „Dlaczego H2SO4 tworzy wiązania wodorowe, skoro jest całkowicie zdysocjowany?” – dwa sprzeczne pytania… Skąd się one biorą i dlaczego się regularnie pojawiają?
H2SO4 tworzy wiązania wodorowe pomiędzy swoimi cząsteczkami, bo jest związkiem kowalencyjnym – zbudowanym z cząsteczek, a nie z jonów. Co innego, gdy będzie to rozcieńczony wodny roztwór, w którym cząsteczek H2SO4 może nie być. Po prostu widzimy chaos, jaki się wiąże z tym, że edukacja mentalnie jest w XIX wieku. Kto nie odrobił zadania domowego? Uczniów o to nie posądzam, bo nie są winni temu, że podręczniki czegoś nie wyjaśnią, albo wręcz wprowadzają w błąd. Natomiast zadania domowego nie odrobiła część autorów zbiorów zadań.
Jaka jest recepta na zmianę tego? Uczyć tak, żeby było dobrze. Wydawanie kolejnych kolorowych podręczników (ale czy lepszych, bo nowszych?) nic nie zmieni, póki nie sięgnie się do źródła problemu. Czyli niedomówień, zdawkowości jak i tkwieniu edukacji w XIX wieku, czyli w czasach, w których miała prawo funkcjonować teoria Arrheniusa. A system edukacji należy poprawić nie tylko dodając więcej kolorowych obrazków do podręczników. I żeby nie było, pewien podział związków na klasy jest potrzebny, np. sole to potrzebne pojęcie. Ale trzeba znać ich ograniczenia i wiedzieć skąd się wzięły, jeśli ma to funkcjonować dobrze i nie wprowadzać zamieszania.
Nie jestem za tym, żeby zamiast nazwy kwas siarkowy(VI) w podręcznikach szkolnych pojawiła się nazwa dihydroksy-λ6-sulfanodion. Ale chcę, by jakoś odróżniać kwas (czyli roztwór odpowiedniej substancji w wodzie, w którym ta substancja pełni rolę kwasu) od czystej substancji. Jak więc nazwać H2SO4 czy HNO3 jako związek chemiczny w przystępny sposób? Skoro jest zasada i wodorotlenek, to może warto wyróżnić kwas i np.: zakwaśnik? Rezerwuję sobie ten termin.
H2SO4(aq) – układy H2SO4-H2O to kwas siarkowy(VI)
H2SO4 – czysty związek chemiczny to zakwaśnik siarkowy(VI)
CH3COOH(aq) – układy CH3COOH-H2O to kwas octowy
CH3COOH – czysty związek chemiczny zakwaśnik octowy
A co w przypadku st. H2SO4, czyli mieszaniny H2SO4 z wodą, w której H2O stanowi 4% udziału? Czy wobec mojej propozycji można ją nazwać stężonym kwasem siarkowym(VI)? Można, bo to mieszanina, w której H2SO4 pełni rolę kwasu wobec drugiego składnika. Tak więc pomimo pewnej luźnej propozycji (ale wartej rozważenia, bo nie zawsze warto trwać w tradycji) nazwa stężony kwas siarkowy(VI) jest zasadna, bo dotyczy mieszaniny H2SO4-H2O, a nie czystego (100%) związku o wzorze H2SO4.
Na sam koniec: o H2SO4 myślimy bardzo źle po edukacji chemicznej. Masa ludzi spodziewa się bardzo gwałtownej reakcji po wrzuceniu jakiegoś aktywnego metalu do st. H2SO4. Ło Panie, co to będzie działo! Pewno nic, tylko uciekać. W końcu to mocny kwas! Tymczasem wrzucamy i co się dzieje? No właśnie – niewiele, co można zobaczyć na filmie klikając tutaj. Ale jeszcze polecam zobaczyć ten film, w którym omawiam kwestię reakcji miedzi ze st. H2SO4 – co o tej reakcji myślimy, a jak to wygląda w rzeczywistości? I znowu edukacja nas oszukała 🙂
