Zdążyć przed maturą, II
Wzorem ubiegłego roku – przedstawiamy kolejną porcję zagadnień nurtujących maturzystów. A w sumie nie tylko maturzystów 🙂 Zeszłoroczna porcja zagadnień dostępna jest tutaj.
1. Reakcje metali z kwasami
Podstawa programowa wymaga znajomości przebiegu reakcji kwasów nieutleniających z metalami: Na, K, Ca, Mg, Al, Zn, Fe, Mn, Cr. Oraz kwasów utleniających z metalami: Mg, Zn, Al, Cu, Ag, Fe. Jak widzimy, podstawa nie obejmuje znajomości przebiegu reakcji chromu z kwasami nieutleniającymi, choć czasem widuję zadania z nim bez podania odpowiedniej informacji wstępnej. Dodatkowo, jak zapewne część z was sama zauważyła, o reakcjach metali z kwasami krążą sprzeczne informacje. Z pomocą przychodzi tabela, opracowana specjalnie dla maturzystów. Tabelę w formacie pdf, wraz z komentarzem, można pobrać:
Jest to zaktualizowana wersja starszej tabeli, która powstała przy moim udziale.

Pamiętaj, że dla najistotniejsze jest wiedzieć, czym się charakteryzuje kwas utleniający, a czym nieutleniający, niż starać się zapamiętać wyjątkowość niektórych reakcji.
Ponadto można obejrzeć serię filmów poświęconą reakcjom metali z kwasami naciskając tutaj.
2. szereg aktywności metali a karta wzorów CKE
Znajduje się tam szereg napięciowy metali, a właściwie szereg elektrochemiczny wybranych metali, który choc traktowany jak szereg aktywności metali – nie do końca nim jest. Zwróćmy uwagę, że nawet NIE jest nazwany szeregiem napięciowym metali (aktywności metali). Pewne dwa przypadki wymagają szerszego komentarza.
Którą pozycję w szeregu aktywności metali zajmuje żelazo?
Zauważcie, że żelazo pojawia się dwukrotnie:
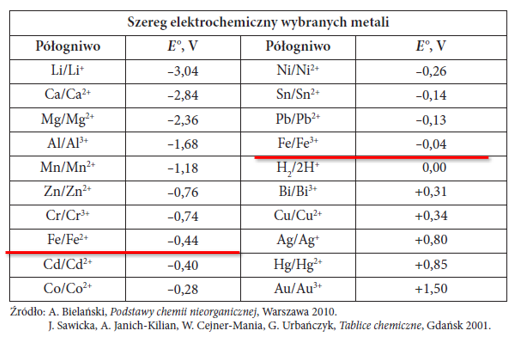
Fe/Fe2+ z potencjałem standardowym -0,44 V
Fe/Fe3+ z potencjałem standardowym -0,04 V
Którą pozycję w szeregu aktywności zajmuje więc żelazo? Ponadto – skoro obydwa półogniwa mają ujemny potencjał, to powoduje to częstą zagwozdkę uczniów, a także części nauczycieli: czy w reakcji z kwasami nieutleniającymi powstaje kation Fe2+, czy Fe3+? Albo które metale może wyprzeć metaliczne żelazo? Lub pytania o to, do czego utlenia się żelazo w reakcjach wypierania: do Fe2+ czy do Fe3+ i jak zajdzie reakcja np. z Ni – bo zależnie o tego na które półogniwo spojrzymy, to otrzymamy sprzeczne wnioski. Rozpatrując parę Fe3+ i Cu – to posługując się kartą wzorów – dojdziemy do błędnych wniosków. Bo wniosek taki, że taka reakcja nie zachodzi, co nie jest prawdą.
Obydwa półogniwa mają ujemny potencjał, a więc możliwa powinna być reakcja: 2Fe + 6HCl ===> FeCl3 + 3H2. Ale taka reakcja nie zachodzi.
Półogniwa Fe/Fe3+ nie ma w szeregu aktywności metali, bo w szeregu aktywności metali nie ma dublowania się przypadków. Wyznacznikiem aktywności żelaza jest to półogniwo o niższym potencjale: Fe/Fe2+ -0,44 V. Żelazo przechodzi wtedy na Fe2+ i jest aktywniejsze od Sn czy Pb.
Natomiast do Fe3+ utlenia się dopiero Fe2+, a potencjał utlenienia Fe2+ do Fe3+ jest dodatni, podobnie jak np. Cu do Cu2+). Tylko kwasy utleniające mogą utlenić Fe do Fe3+, ale poprzez Fe2+ jako etap przejściowy. Półogniwo Fe/Fe3+ wprowadza w błąd co do aktywności również autorów części zbiorów – zadania oparte o zupełnie błędne założenia obecne też w zbiorach zadań, które obecnie są popularne wśród maturzystów.
Jeśli do r-ru FeCl2 wprowadzimy Cu, to reakcja nie zajdzie – zgodnie z tym, co odczytujemy w szeregu. Część nauczycieli i autorów twierdzi też, że nie zajdzie reakcja Cu + FeCl3, patrząc na potencjał tego półogniwa Fe/Fe3+. I faktycznie NIE ZAJDZIE reakcja wypierania metali, ale ale ZAJDZIE taki redoks: Cu + 2FeCl3 ==> CuCl2 + 2FeCl2. Półogniwo Fe2+/Fe3+ ma wyższy potencjał, niż Cu/Cu2+:
+0,76 V dla Fe3+/Fe2+
+0,34 V dla Cu2+/Cu.
Stąd zajdzie redukcja Fe3+ do Fe2+ (ale nie do Fe) i utlenienia Cu do Cu2+. Ale to nie jest wypieranie metali, bo metal nie wyparł innego metalu.
Półogniwo Fe2+/Fe3+ to nie jest półogniwo metaliczne, i z tego powodu nie ma go w tym szeregu elektrochemicznym metali w karcie wzorów, przez co NIE MOŻNA na podstawie karty wzorów stwierdzić zachodzenia reakcji Fe3+ z Cu. A stosuje się tę reakcję w elektronice do wytrawiania tzw. płytek drukowanych.
Analogiczny przypadkiem jest półogniwo Cr/Cr3+. NIE WYZNACZA ONO POZYCJI CHROMU W SZEREGU AKTYWNOŚCI METALI. Chrom, podobnie jak żelazo, w reakcjach z kwasami nieutleniającymi daje sole Cr2+, w reakcjach wypierania metali także bierze udział kation Cr2+, a nie Cr3+, bo ten drugi redukuje się do Cr2+, a nie do Cr., spójrzmy na potencjały standardowe półogniw chromowych:
Cr2+/Cr -0,913 V
Cr3+/Cr -0,744 V
Cr3+/Cr2+ -0,407 V (półogniwo niemetaliczne)
Para Cr/Cr2+ ma potencjał -0,913 V i to ona jest wyznacznikiem aktywności chromu. Z potencjału wynika, że chrom jest metalem aktywniejszym niż cynk – nie można cynkiem wyprzeć chromu, choć na pierwszy rzut oka w kartę wzorów – można. Można za to cynkiem zredukować Cr3+ do Cr2+, bo potencjał redukcji wynosi -0,407 V.
W jednym z arkuszy pojawiło się zadanie, w którym należało napisać reakcję chromu z kwasem solnym. Schemat oceniania tego zadania uwzględniał zarówno powstawanie CrCl2, jak i CrCl3, bo na podstawie karty wzorów można było wyciągnąć wniosek o tym, że powstaje CrCr3.
3. Woda bromowa i benzen
Woda bromowa lub roztwór bromu w CCl4 służą do szybkiej identyfikacji związków nasyconych i nienasyconych. Zachowanie się roztworu bromu w CCl4 można zobaczyć w tym filmie.
Zachowanie wody bromowej jest nieco inne, ze względu na praktyczny brak mieszalności wody z większością badanych substancji. W przypadku wody bromowej powstaje układ dwufazowy. Brom, jako lepiej rozpuszczalny w niepolarnych rozpuszczalnikach łatwo przechodzi do fazy organicznej i, jeśli reaguje ze związkiem organicznym, to tam ulega właściwej reakcji. Dlatego nawet przy braku reakcji woda bromowa znacznie traci na intensywności barwy, ale faza organiczna się zabarwia. Natomiast w przypadku reakcji z bromem cała zawartość probówki ulega odbarwieniu – nie tylko sama woda bromowa, ale także faza organiczna. Co widać na fotografiach poniżej – po lewej zawartość próbówek w chwili zmieszania, po prawej – po 30 sekundach wstrząsania. Od lewej: woda bromowa, woda bromowa i chloroform (CHCl3), woda bromowa i n-pentan (C5H12), woda bromowa i cykloheksen (C6H10) i woda bromowa i benzen (C6H6).

Zwróćmy uwagę na to, że cykloheksen w ogóle nie się nie zabarwił – bo na bieżąco reaguje z bromem, który się w nim rozpuszcza. Pozostawienie układu na świetle powoduje odbarwianie warstwy alkanów (substytucja rodnikowa). Natomiast benzen nie odbarwia się się na świetle – dlatego można go odróżnić od alkanów i alkenów.

W obecności wody nie działa także FeBr3 – nie jest prawdą, że układ się odbarwi w obecności FeBr3, bo woda uniemożliwia powstanie właściwego kompleksu katalitycznego i takie bromowanie benzenu przeprowadza się w bezwodnym środowisku. Reakcję tę można zatrzymywać przed dodatek wody, która powoduje rozpad kompleksu katalitycznego.
4. Szafirowe kompleksy Cu(OH)2
Jest faktem powszechnie znanym, że glicerol i cukry roztwarzają świeżo strącony osad Cu(OH)2 tworząc szafirowe roztwory związków kompleksowych. Powszechnie sądzi się też, że można tak odróżnić alkohole polihydroksylowe od monohydroksylowych, pod warunkiem, że polihydroksylowe zawierają ugrupowania 1,2-diolowe – grupy OH związane z sąsiadującymi atomami węgla, np. jak w cząsteczce etano-1,2-diolu. Co jakiś czas spotykam się także ze stwierdzeniem, że związki z ugrupowaniem 1,3-diolowym także tworzą takie kompleksy. Musimy jednak pamiętać o tym, że nawet jeśli 1,3-diole tworzą związki kompleksowe z Cu(OH)2, to czy tworzą je w takich warunkach, w jakich tę reakcję przeprowadzamy w probówce? Strącamy osad Cu(OH)2 mieszając wodny roztwory CuSO4 (lub innej soli miedzi) z zasadą (sodową lub potasową). Następnie do zawiesiny Cu(OH)2 w wodzie wprowadzamy badany związek – w takich warunkach szafirowe kompleksy tworzą tylko związki z ugrupowaniem 1,2-diolowym, a nie związki z bardziej oddalonymi grupami OH.

Ponadto szafirowe roztwory dają alkohole, a nie fenole z grupami OH przy sąsiednich atomach węgla. Można więc w ten sposób odróźnić diole: alkohol od fenolu. Jak widzimy poniżej benzeno-1,2-diol (a ściślej dianion tego fenolu ze względu na nadmiar NaOH) roztwarza Cu(OH)2 dając roztwór o barwie intensywnie zielonej.

Po lewej widzimy wodny roztwór benzenop-1,2-diolu i strącony nadmiarem zasady Cu(OH)2. Po prawej zielony roztwór kompleksu z Cu(OH)2 (ostatnia próbówka). Roztwór na powietrzu jest nietrwały wskutek utlenia się fenolu (probówka II), natomiast probówka III przedstawia utlenianie się benzeno-1,2-diolu w zasadowym środowisku – widać efekt dyfuzji tlenu, dlatego zawartość zabarwia od góry.
5. Odróżnianie ketoz od aldoz w reakcji cukrów z Br2+NaHCO3(aq)
Zarówno ketozy, jak i aldozy ulegają próbom Tollensa i Trommera, ze względu na izomeryzację ketoz do aldoz w zasadowym środowisku. Z kolei próbie z Br2+NaHCO3(aq) ulegają wyłącznie aldozy, przez co można odróżnić ketozy od aldoz w tej reakcji. Czy ta próba zachodzi w zasadowym środowisku, ze względu na hydrolizę jonu HCO3-? Pamiętajmy, że woda bromowa ma odczyn lekko kwasowy ze względu na zachodzące w niewielkim stopniu dysproporcjonowanie bromu w wodzie (analogicznie do równowagi ustalającej się w wodzie chlorowej). Przyjrzyjmy się reakcji połówkowej utleniania aldozy (np. C6H12O6) do odpowiedniego kwasu:
C6H12O6 + H2O → C6H12O7 + 2H+ + 2e
Zwróćmy uwagę na to, że powstają protony – zatem podczas reakcji środowisko dodatkowo ulega zakwaszeniu. Z tego też powodu w produktach powstaje CO2, jako produkt wypierania kwasu węglowego z anionu HCO3–. Nie jest możliwe wyparcie CO2 w środowisku zasadowym. Jak więc widzimy, pomimo obecności NaHCO3 środowisko reakcji nie jest zasadowe.Rola NaHCO3 jest podwójna: nie pozwala na zbytnie obniżenie pH – wobec braku NaHCO3 produktem redukcji Br2 byłby HBr, który silnie zakwasiłby środowisko, a to mogłoby powodować hydrolizę cukrów złożonych do prostych, które mogłyby zakłócić wynik doświadczenia.
6. Woda i wpływ temperatury na jej pH
Nie milkną echa zeszłorocznego zadania z pH wody. Wszystko wyjaśnia poniższa grafika.

PS częściowo temat został napomknięty w tym filmie, który oczywiście też polecam obejrzeć.
7. Mangan i chrom
Polecam też serię filmów poświęconych reakcjom związków manganu i chromu. Playlista obejmująca; redukcję K2Cr2O7, kolory związków Mn, równowagę chromian-dichromian i amfoteryczność związków Cr dostępna jest tutaj.
8. Kwas mrówkowy a próba Trommera – co pisać maturze?
Czyli perełka na koniec. Odsyłam do gotowego artykułu o tym, naciśnij tutaj.
9. Łagodnie utlenianie alkoholi, czyli co?
Ten fragment dopisuję z powodu pewnej sprzeczności (nie jedynej) w materiale szkolnym. Wiemy, że związki miedzi, takie jak Cu(OH)2 w obecności zasady w próbie Trommera czy też związki srebra jak [Ag(NH3)2]OH w próbie Tollensa są łagodnymi utleniaczami – utleniają aldehydy do karboksylanów, ale nie utleniają alkoholi, dzięki czemu można je odróżnić aldehydy od ketonów w tych próbach. Ponadto uczymy się, że można otrzymać aldehydy (lub ketony) utleniając alkohole silnym utleniaczem, jak K2Cr2O7 w środowisku kwasowym. Możemy utlenić np. etanol do aldehydu octowego, jak i do kwasu octowego – zależnie od sposobu wykonania. Aby utlenić alkohol do kwasu karboksylowego – trzeba przejść przez aldehyd.
Jednocześnie zwykle uczymy się, że można utlenić alkohole do aldehydów łagodnym utleniaczem, którym jest CuO. Łagodnym, żeby nie utlenić alkoholu do kwasu, a do porządanego aldehydu.
Podsumujmy:
Alkohole – utleniają się trudno. Są praktycznie odporne na atmosferyczny tlen (silny utleniacz) – dlatego można je w atmosferze powietrza przechowywać. Ich utlenienie do aldehydu wymaga silnego utleniacza.
Aldehydy – utleniają się łatwo i zwykle nie są odporne na działanie tlenu itp. Są wrażliwe na słabe utleniacze, takie jak Cu(OH)2/OH– czy [Ag(NH3)2]+. Zobaczmy na ten krótki film:
I teraz zwróćmy uwagę: zwykle uczymy się, że aby utlenić alkohol potrzeba silnego utleniacza, oraz, że aby otrzymać aldehyd z alkoholu – potrzeba łagodnego utleniacza. Czy widzimy wzajemną sprzeczność? To trzeba utleniacza silnego czy łagodnego?
Jeśli w temperaturze pokojowej do probówki z alkoholem wsypać nieco CuO, to nic się nie stanie. Nic się nie stanie, bo CuO jest zbyt słabym utleniaczem. Jest zbyt łagodnym utleniaczem.
Co więcej, w jednym z arkuszy wydawnictw natrafiłem na zadanie, w którym do probówki z alkoholem wsypano CuO i kazano napisać równanie reakcji i objawy. Tyle, że o reakcji nie ma mowy w takim przypadku.
Co mamy rozumieć przez łagodne utlenianie? Słowo łagodne może się odnosić do:
– słabego utleniacza, jak wspomniane;
– łagodnych warunków, np. dla reakcji prowadzonych w temperaturze pokojowej; roztworach o odczynie zbliżonym do obojętnego;
– łagodnego utleniania – w sytuacji gdy atom pierwiastka można utlenić na więcej niż jeden wyższy stopień utlenienia, np. Mn(II) możemy utlenić do Mn(III), Mn(VII), aż do Mn(VII). Przez łagodne utlenianie rozumiemy w tym przypadku utlenienie Mn(II) do Mn(III).
Na czym polega więc łagodne utlenianie alkoholi? Na utlenienie do aldehydu, a nie do kwasów karboksylowych czy CO2.
Czy więc łagodne utlenianie jest równoznaczne z łagodnym utleniaczem lub łagodnymi warunkami? Nie, a powyższa sprzeczność jest tego przykładem. Wróćmy do CuO – to na pozór słaby utleniacz. W temperaturze pokojowej jest zbyt słabym utleniaczem, by ruszyć alkohole, bo te wymagają silnego utleniacza. Jednakże w temperaturach wysokich CuO to nie jest niewiniątko – staje się znacznie silniejszym utleniaczem. Bo właściwości substancji zależą od warunków, w których się znajduje. O ile w temperaturze pokojowej jest rzeczywiście łagodnym utleniaczem i nie zachodzi utlenianie alkoholi, o tyle w wysokich (>250 C) utlenia alkohole. Dlaczego więc powstaje podatny na dalsze utlenianie aldehyd? W takich przypadkach reguluje się to czasem kontaktu alkoholu z CuO – by był jak najkrótszy: pary alkoholu przepuszcza się przez nad złożem CuO, a czas kontaktu reagentów jest taki, że większość powstałego aldehydu opuści już strefę reakcji, zanim zdąży się dalej utlenić. Gdyby ten czas kontaktu wydłużyć – aldehyd ulegałby utlenianiu i spadłaby jego wydajność. Zauważmy, że podobnie jest w zakwaszonym roztworze K2Cr2O7 – można otrzymać aldehyd, tylko trzeba ten aldehyd sprytnie usuwać, zanim się zdąży utlenić dalej, ponadto stosuje się nadmiar alkoholu.
PS Jeśli potrzebujesz pomocy w przygotowaniach do matury to zapraszam Cię na moje lekcje online. Na stronie Powtórki z chemii znajdziesz nagrania na których omawiam całą podstawę programową. Dzięki tym filmom opanujesz niezbędną teorię oraz rozwiążesz mnóstwo zadań maturalnych. Lekcje można odtwarzać wielokrotnie i ma się do nich dostęp przez rok. Więcej informacji znajdziesz TUTAJ. 🙂
